
Проблемы Эволюции |
О взрывном видообразовании, протекающем на наших глазах в высыхающем Аральском море. Омск: Изд-во Омского государственного педагогического университета, 2003. 382 с.
Эволюция двустворчатых моллюсков Аральского моря обусловлена эволюцией его экосистемы, которая в свою очередь на современном этапе определяется взаимодействием двух процессов: акклиматизацией гидробионтов и осолонением моря в результате его регрессии. В связи с этим перед обсуждением эволюции двустворчатых моллюсков Аральского моря необходимо предварительно рассмотреть эволюцию экосистемы Аральского моря.
Под эволюцией экосистем, согласно В.В. Жерихину (1994) и А.С. Северцову (1998), понимаются такие преобразования, которые приводят к стабильно воспроизводящимся изменениям их состава и структуры.
Еще в начале двадцатого века было обращено внимание на своеобразие и ненасыщенность экосистемы Аральского моря по сравнению с другими южными морями, позволившие говорить о биологической загадке Арала и называть его «патологическим» водоемом (Беклемишев, 1922, 1923). Своеобразие экосистемы Арала заключалось в обедненном видовом составе при преобладании генеративно-пресноводных видов, а также отличном от южных морей и океана путем трансформации вещества и энергии (Карпевич, 1975).
В первой половине 20 века, считалось, что вследствие малого разнообразия фауны имеющиеся виды не способны использовать все кормовые ресурсы водоема, в связи с чем его необходимо пополнить ценными промысловыми видами и кормовыми для рыб беспозвоночными. Всего за 1927–1987 гг. в море были целенаправленно вселены или проникли без учета микроскопической флоры и фауны 16 видов беспозвоночных и 22 вида рыб, в результате чего коренным образом была изменена его фауна (Кортунова, 1970; Карпевич, 1975; Маркова, 1975; Андреев, Андреева, 1995а; Андреев с соавт., 1995; Андреев, 1999; и др.).
С 1927 г., когда было проведено первое вселение севрюги (Коновалов, 1959), этап естественной анагенетической эволюции экосистемы Арала сменился интродукционным этапом. Начиная со второй половины 1950-х годов, практически постоянно происходила перестройка структурно-функциональных связей экосистемы моря под воздействием волн расселения и вспышек численности акклиматизантов. В 1956–1961 гг. — расселение и вспышка численности короткоцикличных рыб: салаки, атерины, бычков, и ракообразных: креветки и мизид; 1963–1976 гг. — нереис и синдосмии; 1971–1973 гг. — калянипеды; 1976–1985 гг. – голландского краба; 1987–1991 гг. — камбалы-глоссы.
С начала 1960-х годов интродукционный этап в эволюции экосистемы Аральского моря сменился этапом, когда в эволюции моря большую роль стали играть и экзогенные процессы, вызывавшие снижение уровня и осолонение крупного водоема. Главенствующая роль на данном этапе эволюции экосистемы принадлежала повышению солености воды моря, так как для существования большинства исконно аральских, а также и акклиматизированных гидробионтов, соленость воды имела определяющее значение, поскольку превышение верхних границ толерантных диапазонов видов вело к их вымиранию. К началу 1990-х годов резко уменьшилось биоразнообразие. В море сохранилось только 5 видов макрофитов из 37 (Доброхотова, 1971; Orlova et all., 1998), 7 видов зоопланктона из 49, 27 видов зообентоса из 61 и 9 видов рыб из 33 (Андреева, 1989; Андреев, 1999).
Сокращение видового состава носило не плавный характер, а было приурочено к определенным соленостным границам. Так, последствия осолонения воды начали сказываться на фауне Аральского моря с середины 1970-х годов, когда соленость воды в море достигла 12–14 ‰. Именно эта соленость в Аральском море является барьером критической солености (=хорогалинная зона, мезогалинный барьер), разделяющим два главных типа фаун – пресноводную и морскую. Поэтому повышение солености воды всего на 2–4 ‰ вызвало кардинальные перестройки в фауне моря. Пресноводные эвригалинные виды и каспийские виды, не способные к амфиосмотической регуляции, вымерли, а массовое развитие получили эвригалинные виды морского происхождения и галофильные виды материковых вод. Следующее сокращение видового состава наблюдалось при солености 24–28 ‰, когда выпали солоноватоводные виды и каспийские виды, способные к амфиосмотической регуляции (Андреев, Андреева, 1991б, 1998а; Андреев, 1999).
До 1961 г. интродукционный этап эволюции аральской экосистемы протекал на фоне флюктуационных колебаний основных параметров, свойственных квазистационарному режиму моря. Основным источником поступлений биогенных веществ в Аральское море – основы биологической продуктивности водоема – был речной сток. При этом взвешенные биогенные вещества почти полностью оседали в устьевых областях рек Амударьи и Сырдарьи. Запасы растворенных неорганических форм азота и фосфора в донных отложениях и их поступление в водную толщу были ограничены. Толща вод моря была исключительно бедна биогенными веществами, большая часть моря обладала чертами типичного олиготрофного водоема (Блинов, 1956; Свиридова, 1990; и др.). Для этого состояния экосистемы было характерно преимущественно макрофитное продуцирование первичного органического вещества на фоне высокой прозрачности воды при низкой концентрации биогенов в толще вод. Вертикальное распределение фитопланктона во все сезоны года было аномальным с максимумом видового разнообразия и количественного развития в придонных слоях. Во все сезоны года в фитопланктоне доминировали диатомовые водоросли. Большое значение в продуцировании первичного органического вещества имел и микрофитобентос, поскольку поверхностный слой илов Аральского моря содержал массу микробентических водорослей, состоящих в основном из диатомовых (Яблонская, 1964; Новожилова, Березина, 1970; Пичкилы, 1970; 1971). По исследованиям Е.А. Яблонской (1971) биомасса бентических водорослей была довольно велика и равнялась на разных станциях 5.8–17.2 г/м2.
До зарегулирования стока рек, как показала А.Ф. Карпевич (1975), экосистема Аральского моря, являясь антиподом южных морей и океана, характеризовалась наличием мощной детритной и крайне ослабленной пастбищной пищевых цепей.
В период вспышки численности вселенных короткоцикличных планктонофагов салаки и атерины формируется новое пелагическое звено, в результате чего происходит почти полное уничтожение аральского зоопланктона, биомасса которого снижается в 10 раз. Размножение пелагических рыб способствовало появлению в открытом море жереха и судака, для которых ранее там не было пищи. Интродукция короткоцикличных планктонофагов, бычков, креветки и мизид вызвала изменение соотношения мирных и хищных рыб в экосистеме Арала. Особенно резко реагировали хищники судак и жерех, численность которых ранее сдерживалась из-за недостатка подходящего корма при переходе к хищному питанию. Появление же многочисленных и оптимальных по размеру пищевых организмов повысило выживаемость молоди судака и жереха, в 1960–1970-х годах резко увеличились их уловы (Митрофанов с соавт., 1992; Андреев, Андреева, 1998б; Андреев, 1999). Итак, интродукция короткоцикличных рыб, креветки и мизид вызвала перестройку трофической структуры ихтиофауны, увеличив долю хищных рыб. Сходным образом отреагировал и зоопланктон, при снижении общей биомассы резко возросла доля хищных форм. Трофическая структура зообентоса оставалась еще стабильной (Андреев, Андреева, 1998б).
Преобладание макрофитного продуцирования первичного органического вещества сохранялось, вероятно, и на начальном этапе осолонения моря. К сожалению, в архивах нет документов, подтверждающих время вымирания нитчатой водоросли Vaucheria, являвшейся одним из массовых продуцентов первичного органического вещества при квазистационарном режиме Аральского моря. Во второй половине 1970-х годов нами живой Vaucheria найдено не было, хотя все дно моря, особенно в глубоководных районах, было еще покрыто черным войлоком отмершей Vaucheria.
Начиная с весеннего рейса 1976 г., начала наших работ на Аральском море, живой Vaucheria найдено не было, напротив, в все дно моря, особенно в глубоководных районах, было покрыто черным войлоком отмершей Vaucheria.
Начиная с весеннего рейса 1976 г., начала наших работ на Аральском море, живой Vaucheria найдено не было, напротив, в все дно моря, особенно в глубоководных районах, было покрыто черным войлоком отмершей Vaucheria.
Обильные заросли макрофитов сохранялись, в основном, вдоль восточного побережья и в заливах (рис. 9.1), в западных районах моря харовые водоросли и Zostera встречались на глубинах до 9–10.5 м. Воды моря были прозрачны (максимальная прозрачность в рейсах 1978 и 1980 гг. была 16 м) и бедны биогенными веществами. Грунты были покрыты слоем наилка толщиною от 0.3 до 1.5 см, содержащего микробентические организмы. Уменьшение продукции первичного органического вещества макрофитами, вероятно, на первом этапе частично компенсировалось на большей части акватории первичной продукцией микрофитобентоса, поскольку воды Арала во многих районах были прозрачны до дна. Так, в период стандартной съемки 1978 г. на трети станций воды были прозрачны до дна. Бактериопланктон по-прежнему имел невысокую численность, количество продуцентов первого порядка во второй половине 1970-х лет снизилось в среднем в два раза; наряду с сокращением видового разнообразия микроорганизмов в списках появились типично морские обитатели (Новожилова с соавт., 1981). В конце 1970-х годов изменилось распределение бактерий по горизонтам, на 65,7 % станций стандартной сетки отмечено нарастание биомассы бактериопланктона в придонных слоях, в то время как в 1966 г. подобное явление отмечалось лишь на 38 % станций. Количество и биомасса микробов в иловых отложениях снизилось в среднем в два раза, снизилась и продукция (Новожилова с соавт., 1984). В связи с вымиранием пресноводных и солоноватоводных видов происходит дальнейшая перестройка трофической структуры зоопланктона и ихтиофауны, а также и зообентоса Арала, преобладающей в экосистеме остается детритная пищевая цепь (Андреева, Андреев, 1990б; Андреев, Андреева, 1998б).
Рассматривая эволюцию континентальных водоемов с начала палеозоя, Я.И. Старобогатов (1984) замечает, что их эволюционные изменения напоминают ряд изменения трофности. В эволюции экосистемы Аральского моря также наблюдалось изменение трофности толщи вод, чем и был обусловлен переход к ее диверсификационному этапу. В ходе своего деградационного развития под разрушающим воздействием экзогенных процессов экосистема Аральского моря достигла этапа, когда в силу изменения гидрологического, гидрохимического и гидробиологического режимов произошла трансформация внутреннего круговорота биогенных веществ. Сопоставление режима биогенных веществ в 1960-е, 1970-е и 1980-е годы свидетельствует о значительном росте их концентраций во всей водной толще моря во все сезоны безледного периода. Резкий и устойчивый рост средних концентраций всех биогенных веществ наблюдался для периода 1981–1985 гг. при ослаблении или прекращении биогенного стока рек. В 1980-е годы первостепенное значение в режиме биогенных веществ стало принадлежать процессам внутреннего круговорота биогенных веществ и обмена на границе вода – дно. При этом регистрируется максимальное содержание биогенов в толще вод за 1961–1985 гг. (Свиридова, 1990).
<![if !vml]>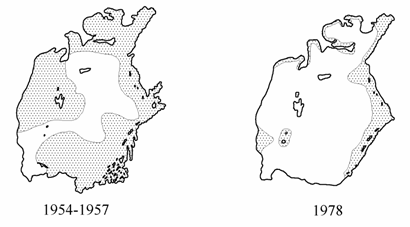 <![endif]>
<![endif]>
Рис. 9.1. Распределение макрофитов (заштриховано) в Аральском море (1954-1957 гг. по: Яблонская, 1964).
Начавшийся в 1970-х годах процесс выпадения макрофитов завершился в конце 1980-х вымиранием большинства аральских видов. При возобновлении исследований моря в 1989 г. отмечено отсутствие харовых водорослей, резкое сокращение площадей Zostera и Ruppia, для произрастания которых в Аральском море необходимы были песчаные грунты, обнажившиеся из-за снижения уровня моря. Одновременно наблюдалось резкое снижение прозрачности воды, которая в августе 1992 г. в районе западной глубоководной котловины не превышала 9–10 м, в центральной части Большого моря — 5–7 м, в Малом море – 4 м. Снижение прозрачности воды обусловлено, скорее всего, массовым развитием фитопланктона, численность которого колебалась осенью 1991 г. в заливе Бутакова от 64 до 516 млн. кл./м3, в Малом море от 28 до 236 млн. кл./м3 (Королева, 1993) против 25.2 млн. кл./м3 в среднем по морю в июле 1980 г. (Пичкилы, 1981).
Повышение содержания биогенных веществ в толще вод приводит к резкому увеличению [по данным М.И. Орловой (1993) не менее, чем на порядок] продуцирования первичного органического вещества и усилению пастбищной пищевой цепи, которая становится равноценной детритной или даже более мощной. По типу формирования первичного органического вещества экосистема Аральского моря с начала 1980-х годов стала приближаться к экосистемам южных морей России. В частности, по величинам Р/В коэффициента бактериопланктона А.В. Сулялина и А.О. Смуров (1993б) считают возможным отнести Малое море к водоемам мезотрофного типа.
Итак, к началу 1990-х годов коренным образом изменились флора и фауна Аральского моря, количественное распределение организмов по дну и в толще вод; произошла перестройка трофической структуры зоопланктона, зообентоса и ихтиофауны, а также смена типа продуцирования первичного органического вещества.
С позиций трофической структуры сообществ в первой половине 1980-х годов в экосистеме Арала в силу различной солеустойчивости уцелел случайный набор видов, при этом отдельные трофические группировки были полностью утрачены. В зоопланктоне, зообентосе и ихтиофауне, практически, исчезли все хищники.
До зарегулирования стока рек в донных биоценозах Аральского моря преобладали сестонофаги, в распределении трофических группировок наблюдалась хорошо выраженная зональность (Андреева, Андреев, 1990б), сохранявшаяся до второй половины 1960-х годов. Исследование трофических связей в донных сообществах Аральского моря Е.А. Яблонской (1971, 1976, 1979) показало, что трофическая структура зообентоса Аральского моря оставалась постоянной и в начальный период его осолонения. Аральские двустворки использовали в пищу различные кормовые объекты, расходясь по спектрам питания. При перекрывании спектров питания, например у гипанис и церастодермы, количественное развитие одного из моллюсков при совместном обитании в море в силу конкурентного исключения было крайне невелико.
Исследования питания моллюсков южных морей СССР (Яблонская, 1971, 1976; Yablonskaja, 1979) показали, что состав пищевого комка неподвижных сестонофагов отличен от состава пищевого комка подвижных сестонофагов и собирающих детритофагов. Пища неподвижных сестонофагов, куда относятся аральские дрейссены, сходна с составом водной взвеси и состоит из мелкозернистого детрита и большого количества планктонных водорослей, размер минеральных частиц в пище не превышал 13–27 мкм. В пище собирающих детритофагов (синдосмия) эти компоненты составляли незначительную долю. Основой содержимого кишечника были органо-минеральные скопления, образующиеся в поверхностном слое грунта с минеральными частицами до 75–78 мкм. Состав пищи подвижных сестонофагов (церастодермы и гипанисы), извлекаемой из водной толщи и выдуваемой из осадка имел промежуточный характер; основную массу составлял планктоногенный детрит, мелких планктонных водорослей было значительно меньше, чем у неподвижных сестонофагов.
Со второй половины 1960-х годов проявляется нарушение зональности в распределении трофических группировок аральского зообентоса в связи с изменением ареалов из-за осолонения моря и расселения акклиматизантов (Андреева, Андреев, 1985, 1990б). Последующие критические нарушения гидролого-гидрохимического режима Аральского моря, вызвавшие необратимые изменения в видовом составе и смену пресноводной и солоноватоводной фаун на эвригалинную морскую и галофильную материковых вод, на фоне ограниченного видового состава повлекли за собой перестройку трофической структуры зообентоса. Это явление исключительного порядка, поскольку для трофической структуры морской донной фауны характерна устойчивость и долговечность, ее перестройка происходит лишь под воздействием значительных изменений режима водоема, причем в плане перестройки экосистемы водоема в целом (Кузнецов, 1980).
Итак, причиной перестройки трофической структуры донной фауны Аральского моря послужили его осолонение и сопутствующее вселение собирающих детритофагов, повлекшие за собой сокращение трофических зон сестонофагов и расширение зоны собирающих детритофагов.
Распределение трофических зон в море обуславливается комбинацией ряда факторов, определяющих для донных беспозвоночных условия питания, как-то рельеф дна, характер осадков, гидродинамические процессы и процессы осадконакопления (Кузнецов, 1980; и др.). В Аральском море в этот период распределение трофических зон было обусловлено не гидрологическими и продукционными процессами, а имеющимся видовым составом, поскольку в составе зообентоса к концу 1970-х лет сохранились только собирающие детритофаги и один подвижный сестонофаг. Полностью была утрачена группировка неподвижных сестонофагов, имеющая большое значение в функционировании экосистем других морей и океанического шельфа (Андреева, Андреев, 1990б; Андреев, Андреева, 1998б).
Исследованиями морских экологов было показано (Кузнецов, 1980), что морское донное население в процессе приспособления к использованию послойно распределенных в море форм пищевого материала соответственно распределено по трофическим ярусам. В результате вымирания неподвижных сестонофагов верхний трофический ярус донной фауны в Аральском море оказался свободен. Именно отсутствие неподвижных сестонофагов, располагающихся на грунте или над ним и питающихся из водной толщи, предопределило в сложившихся условиях давление отбора в сторону формирования группы моллюсков, максимально возвышающейся над грунтом и использующих верхний слой доступных донному населению пищевых ресурсов.
Было установлено, что Cardiidae обладают наивысшим по сложности развития фильтрующим аппаратом (Purchon, 1968; Newell, 1970), при этом сестонофагия у Cardium (Cerastoderma) достигла полного развития и получение пиши иным способом для них совершенно исключено (Кузнецов, 1980). Итак, из всех сохранившихся форм зообентоса Cerastoderma как типичные облигатные сестонофаги были наиболее специализированной формой, преадаптированной всей своей предшествующей историей к возможности смены стратегии питания в сторону еще большей специализации – переходу к фильтрации только из водной толщи. Именно в силу облигатной сестонофагии при повышении трофности толщи вод и отсутствии конкуренции со стороны неподвижных сестонофагов часть Cerastoderma оказались способными освоить свободную трофическую нишу и заполнить вакантные лицензии экосистемы.
Итак, высвобождение лицензий эпифаунистических моллюсков вследствие вымирания всех дрейссен способствует выходу части популяции инфаунных Cerastoderma на поверхность грунта – в новую адаптивную зону. Этот процесс стимулировался еще, вероятно, конкуренцией со стороны инфаунных, пластичных в пищевом отношении Syndosmya, имевших очень высокую численность и биомассу. Выход на поверхность грунта осуществлялся постепенно путем смены нескольких поколений моллюсков, хотя в палеонтологических масштабах может считаться скачкообразным.
Ретроспективный анализ изменения фауны по градиенту солености и экспериментальные работы по солеустойчивости аральских гидробионтов позволили нам (Андреев, Андреева, 1981, 1990а, б, 1991б, 1998а; Андреева, Андреев, 1988) определить границы, в которых наблюдаются качественные изменения фауны и флоры, определяемые соленостной резистентностью различных по происхождению видов.
Первый качественный скачок обнаруживается в пределах олигогалинного барьера (соленость 3–5 ‰). Так, в реках, придаточных и дельтовых водоемах Амударьи и Сырдарьи зарегистрирована довольно разнообразная фауна двустворчатых и брюхоногих моллюсков сем. Unionidae, Corbiculidae, Pisidiidae, Bithyniidae, Lymnaeidae, Physidae и Planorbidae (Сидоров, 1929; Жадин, 1952; и др.). Однако в открытом море представители этих семейств никогда не были найдены, за исключением сильно опресненных южных заливов (Бенинг, 1934; Деньгина, 1954, 1957; Хусаинова, 1958; и др.). Проникновению их из опресненных приустьевых областей в осолоненные районы препятствовало наличие олигогалинного барьера 3–5 ‰, ограничивающего, в основном, и в настоящее время распространение элементов пресноводной фауны дельтовыми водоемами Сырдарьи и Амударьи. Этот барьер не универсален, он легко преодолим для аральских рыб в силу особенностей их осморегуляторной системы. Для других же групп организмов, в частности для моллюсков, соленость 3–5 ‰ является существенным барьером, препятствующим расселению вышеуказанных семейств моллюсков в более соленые воды. Преодоление этого барьера возможно лишь благодаря совершенствованию или возникновению новых осморегуляторных механизмов. Подобные приобретения, вероятно, являются преобразованиями арогенного ранга, обеспечивающими проникновение групп организмов в солоноватые или соленые воды.
Вторая барьерная соленость 12–14 ‰ (мезогалинный барьер) была границей расселения по акватории Арала представителей солоноватоводной фауны, в том числе и двустворчатых моллюсков рода Hypanis, D. obtusecarinata и, вероятно, Cerastoderma rhomboides rhomboides. Поскольку акватория Аральского моря до начала 1960-х годов представляла собой аномально увеличенную зону смешения, заключенную между барьерами 3–5 и 12–14 ‰, то соответствующим было и расселение гидробионтов. Из двустворок соленостный барьер 12–14 ‰ преодолевал лишь один эвригалинный аборигенный вид – C. isthmicum, имевший высокую численность по данным Р.С. Деньгиной (1959а) и Н.З. Хусаиновой (1958) за пределами этого барьера.
Соленость 24–28 ‰ (эугалинный барьер) является границей в распространении солоноватоводных Dreissena caspia pallasi и Theodoxus pallasi, из других типично аральских видов гидробионтов в мезогалинных водных массах обитали судак и девятииглая колюшка. Из двустворчатых моллюсков этот барьер преодолевают Cerastoderma и Syndosmya.
Следующий гипергалинный барьер (40–45 ‰) выявлен, в основном, экспериментальным путем. Он совпадает с верхней границей толерантного диапазона средиземноморских представителей аральской фауны, в том числе Cerastoderma и Syndosmya.
У эвригалинных видов двустворок, преодолевающих указанные барьеры, углубленный морфологический анализ обнаруживает в пределах барьерных зон резко возросшую изменчивость признаков, приобретающую здесь взрывной характер (см. глава 6–7). Агрессивность среды в пределах соленостных барьеров в силу изменения физико-химических свойств воды (см. глава 3) оказывает мощное воздействие, последствием которого при стечении ряда обстоятельств может стать событие видообразования. Примером служат эволюционные преобразования синдосмии в Аральском море (см. глава 7). На этапе вселения в агрессивную среду при наличии вакантных лицензий видообразовательный процесс идет очень быстрыми темпами. В дальнейшем же при пересечении барьерных соленостей вновь наблюдается чрезвычайная изменчивость морфологических признаков, но вакантных лицензий на уровне инфауны нет и адаптивной радиации не прослеживается.
Именно наличие барьерных соленостей в условиях «глухой» изоляции определяло и определяет специфику фауны Аральского моря и потенции видообразования для определенных этапов существования его экосистемы.
В последнюю регрессию Арала, имевшую место примерно 600 лет назад, в центральной котловине моря существовал проточный водоем, имевший участки с различной соленостью, позволявшие обитать как пресноводным, так и эвригалинным видам (Николаев, 1991). При заполнении котловины Арала пресными водами сохранившиеся виды моллюсков расселялись в соответствии со своими соленостными спектрами. Наличие в прошлом подобных убежищ и монотонность биотопов, скорее всего, и ограничивали видообразовательный процесс тем объемом видов, который когда-то сложился и существовал к началу двадцатого столетия.
Современная регрессия Арала отличается от имевших место в прошлом моря полным отсутствием стока в течение нескольких лет и исключением возможности сохранения солоноватых зон, которые могли бы служить резерватами для переживания стадии осолонения солоноватоводными видами. Формирующиеся в последние годы распресняемые зоны в приустьевом районе Сырдарьи уже не могут служить убежищем специфической аральской олигогалинной фауне, поскольку она вымерла. Здесь возможен только новый этап видообразовательного процесса, при этом кладообразователями, как и в прошлом, вновь могут явиться виды, обитающие в озерах низовьев рек и преодолевшие олигогалинный барьер 3–5 ‰.
Современная регрессия Арала предоставила редчайшую возможность проследить эволюцию экосистемы гигантского озера-моря. Стечение уникальнейших обстоятельств в продолжение короткого периода времени позволило пронаблюдать смену этапа эволюции экосистемы под воздействием экзогенных факторов, оказывавших деградационное влияние, на этап, когда большее значение стали иметь эндогенные факторы, в частности, преобразования процессов первичного продуцирования. Восстановление важнейших структурно-функциональных звеньев экосистемы путем диверсификационных процессов осуществляется в условиях продолжающегося влияния экзогенных факторов.
В определенные периоды времени на биоту Арала, помимо внешних факторов начинают действовать и внутренние, совпадающие с достижением морем в процессе своего осолонения критической и барьерных соленостей. В эти периоды резко возрастает ненаправленная изменчивость.
При отсутствии ценотического контроля, что наблюдалось в Аральском море при вселении Syndosmya и экспансии Cerastoderma в 1960-е годы и в последующем при выходе Cerastoderma на поверхность грунта в 1980-е, на основе массовой ненаправленной изменчивости чрезвычайно быстро отбираются фенотипы, соответствующие уже имеющимся (при вселении) или формирующимся новым условиям обитания. Эта чрезвычайная скорость, с которой «притираются» возникшие фенотипы к новым условиям обитания, создает иллюзию направленного формирования фенотипов средой обитания. Однако, массовая ненаправленная изменчивость среди двустворок Арала (см. глава 6–7) в критические периоды свидетельствует о случайном характере процесса. И только массовое вовлечение в этот процесс двустворок, имеющих колоссальную энергию размножения, способствует успешной работе отбора. Именно массовость материала позволяет сохраняться и размножаться фенотипам (и генотипам), соответствующим новой среде обитания и постепенно (примерно за 10–15 лет), как в случае с эпифаунистическими Cerastoderma, выйти в новую адаптивную зону.
Колоссальные изменения экосистемы Аральского моря не имеют аналогов в современном мире и по результатам сравнимы с эволюционными преобразованиями солоноватых водоемов, существовавших в геологическом прошлом. Если обратиться к палеонтологическим материалам, то поражает сходство описанных палеонтологами процессов с протекающими в конце двадцатого века в Аральском море. Причем, эти процессы имеют универсальный характер. Они присущи в прошлом всему живому нашей планеты, как мезозойским растениям (Красилов, 1986), так и наземным тетраподам ранней и средней юры (Каландадзе, Раутиан, 1992), меловым насекомым (Жерихин, 1992), морским и солоноватоводным кайнозойским моллюскам (Невесская с соавт., 1987, 1989).
Всплеску темпов эволюции всегда предшествует вымирание большей части флоры и фауны. В частности меловой биоценотический кризис начался с изменения растительного покрова суши. Перестройка растительных сообществ повлекла за собой процесс реорганизации по трофическим цепям, который вызвал изменения фауны (Жерихин, 1992; Иванов, 2000). В морских экосистемах резкое изменение физико-химических условий приводили к полной или почти полной гибели фауны морского происхождения. При нарушении стабильности бентосных сообществ изменялась трофическая зональность за счет полного выпадения детритофагов. В этих случаях проявлялась, как правило, потенциально возможная высокая скорость эволюции моллюсков (Невесская, Попов, 1976; Невесская с соавт., 1989), позволявшая восстановить биоту водоемов за счет таксонов, составлявших ранее незначительную ее часть.
Аналогичные явления наблюдались в Аральском море в двадцатом столетии. Видообразовательному процессу предшествовали события вымирания по всей акватории моря (в случае всплеска видообразования эпифаунистических Cerastoderma) или же в отдельных районах, совпавших в 1960-е годы с районами вселения Syndosmya. Вследствие вымирания изменилась трофическая структура зоопланктона, зообентоса и ихтиофауны. Последовавшая смена типа продуцирования первичного органического вещества, повышение трофности толщи вод, невозможность притока иммигрантов из-за отсутствия связи с морем и наличия соленостных барьеров, для преодоления которых необходимо изменение осморегуляторных механизмов, делали возможным расширение структурно-функциональных связей в экосистеме только за счет диверсификационных процессов.
В связи с регрессией Аральского моря и ускорением сопровождающих ее процессов во второй половине двадцатого столетия скорость эволюции его экосистемы резко возросла. Максимальные темпы эволюционных преобразований всех составляющих экосистемы отмечены со второй половины 1980-х годов. К этому времени из солоноватого водоем превратился в «морской» со специфическим составом солей, пресноводная и солоноватоводная флора и фауна сменились морской и галофильной материковых вод с сопутствующей перестройкой трофической структуры основных составляющих экосистемы и путей трансформации вещества и энергии. Вряд ли представляется возможным в этот период говорить только о деградации экосистемы Аральского моря, судя по факту вымирания солоноватоводной фауны. Если 1960-е годы можно охарактеризовать как этап разрушения экосистемы в ответ на вселение короткоцикличных рыб, 1970-е годы – как деградационный этап в ответ на преодоление экосистемой моря зоны критической солености, то в последующем, вероятно, ближе к середине 1980-х годов вследствие трансформации внутреннего круговорота биогенных веществ (см. Свиридова, 1990) начинается процесс усложнения предельно упростившейся экосистемы. За счет внутренних резервов на фоне колоссального возрастания численности единичных форм идет видообразовательный процесс, поскольку вследствие вымирания большей части фауны освободились многие лицензии, а в результате смены типа продуцирования первичного органического вещества сформировались и новые. Вполне вероятно, что при тщательных фаунистических исследованиях возможны таксономические находки и в других группах организмов.
Таким образом, в результате современного кризиса экосистемы Аральского моря произошло вымирание его пресноводной и солоноватоводной флоры и фаун, всегда предшествовавшее взрыву видообразования в геологическом прошлом. Смена типа продуцирования первичного органического вещества, сопровождающаяся повышением трофности водной толщи, обусловила переход анагенетической эволюции экосистемы Аральского моря к этапу, когда ведущая роль принадлежит диверсификационным процессам; в результате их развития началось частичное восстановление структуры экосистемы.
Воздействие современной регрессии Арала на его фауну является прекрасной моделью процессов, протекавших в геологическом прошлом при регрессиях морских и солоноватых палеоводоемов, а само море представляет собой природную лабораторию для наблюдений за эволюционными процессами в пределах отдельных таксонов и экосистемы в целом. Универсальный характер наблюдаемых преобразований позволяет говорить о современной эволюции экосистемы Арала как модели эволюции биот.
Изучение эволюции экосистемы Аральского моря в ходе современной регрессии может прояснить значение барьерных соленостей в видообразовании и формировании фаун. Барьерные солености разграничивают водные массы со специфическим составом солей и соотношением ионов, являющиеся специфической ареной жизни. И неважно каким образом формируются водные массы, в процессе ли осолонения или распреснения при гидрологических кризисах палеоводоемов, или же как различной протяженности участки водоема при смешении речных и морских вод. Существенно то, что соленостные барьеры являются зонами, где происходит коренная перестройка физико-химических свойств вод, в частности изменяется соотношение ионов в результате растворения или седиментации солей и пр. В силу чего зона барьерной солености представляет собой агрессивную среду, как по отношению к видам, обитающим до барьера, так и по отношению к эвригалинным видам, обитающим по обе стороны барьера.
Для эвригалинных видов, чьи осморегуляторные механизмы позволяют обитать в водных массах по обе стороны барьера, наступление барьерной солености вследствие развития гидрологического кризиса (распреснение или осолонение среды обитания) или же проникновение в зону барьерной солености (при вытеснении конкурентами) вызывает нарушение процесса воспроизводства генетической информации и резкое увеличение амплитуды изменчивости морфологических признаков. Большая часть особей, что явно из экспериментов по солеустойчивости, в зоне барьерной солености погибает. Как правило, выживает 25–30 % особей любого эвригалинного вида моллюсков, которые и составляют ту немногочисленную часть фауны, способную пережить по наблюдениям палеонтологов гидрологический кризис (Невесская с соавт., 1989) и сформировать в последующем таксоны различного ранга, соответствующие новым условиям обитания. Формирование новых таксонов возможно, как это было указано выше, только при наличии свободных лицензий экосистемы. Вакансии же появляются в результате вымирания фаун, сопровождающего любой гидрологический или биоценотический кризис.
Для видов, границы соленостной толерантности которых не выходят за пределы барьера, барьеры остаются непреодолимой преградой в распространении вдоль градиента солености. В случае наступления гидрологического кризиса они вымирают.
Но иногда, вероятно, в силу колоссального ускорения мутационного процесса и формирования на фоне этого специфических адаптаций появляется возможность проникновения в новую адаптивную зону путем совершенствования осморегуляторных механизмов. Совершенствование осморегуляции позволяет проникнуть за пределы барьера в новую адаптивную зону и при отсутствии конкурентов, что, вероятно, всегда и имело место в геологическом прошлом при освоении формирующихся водных масс (в период гидрологических кризисов или при заполнении котловины в результате повышения стока или миграции русел и дельт рек), ведет к адаптивной радиации внутри водной массы. Хорошим примером могут служить солоноватоводные каспийские моллюски, проникшие, как указывает Я.И. Старобогатов (1970), в апшероне из морских вод в каспийскую котловину и сформировавшие при освоении водных масс Каспия достаточно богатые видами клады. Так, в современном Каспии род Hypanis насчитывает 12 форм видового и подвидового ранга, Didacna – 10. Для Арала – это пресноводные дрейссены. При проникновении какой-то части популяции Dreissena polymorpha aralensis за олигогалинный барьер 3–5 ‰ формируется Dreissena obtusecarinata с более совершенным осморегуляторным механизмом (если рассматривать его с точки зрения выживания в более соленой среде) по отношению к предковой форме.
Адаптивная радиация при освоении водных масс специфического состава, существующих длительное время, позволяет сформировать специфическую или эндемичную фауну, защищенную от вторжения конкурентов соленостными барьерами. Проникновение за барьерные солености с событиями видообразования возможно, как уже отмечалось, только при наличии вакантных лицензий, в противном случае обитающие в водных массах виды осуществляют ценотический контроль, отсекая все попытки проникновения в данную зону. Чем, вероятно, и обусловлена стабильность как современных эндемичных солоноватоводных фаун, так и районов их обитания. Вторжение морских эвригалинных видов в зону обитания эндемичной солоноватоводной фауны выше барьерной солености приводит к вымиранию эндемиков или оттеснению их ниже границы барьера.
Таким образом, барьерные солености, ограничивающие водные массы со специфическим составом солей, играют существенное значение в формировании и эволюции водных экосистем. Преодоление барьерных соленостей требует формирования морфо-физиологических адаптаций, не всегда сопровождающихся существенными морфологическими различиями. В случае освоения новым видом сходной экологической ниши морфологические различия с предковыми формами могут быть невелики. При наличии морфо-физиологических адаптаций, позволяющих существовать по обе стороны барьера, барьерная соленость выступает в роли стрессового фактора, ведущего к интенсивному видообразовательному процессу, который при наличии вакантных лицензий в экосистеме завершается не только событием видообразования, но и формированием таксонов более высокого ранга, что неоднократно наблюдалось в геологической истории палеоводоемов. Эволюционные процессы, сопровождающие последний гидрологический кризис современного Аральского моря, являются моделью эволюционных преобразований экосистем водоемов, существовавших в геологическом прошлом.
В течение последнего столетия в состав фауны Аральского моря входили двустворчатые моллюски 4 родов: Dreissena, Hypanis, Cerastoderma и Syndosmya, для каждого из которых характерна своя история проникновения в Аральское море и последующая эволюция в этом водоеме.
По последним изысканиям (Иззатуллаев, Старобогатов, 1991) моллюски р. Dreissena проникли в Аральскую котловину в апшеронское время. Находка еще одного вида Dreissena balkhashensis Star. et Tolst. (Старобогатов, 1994) в плиоценовых отложениях западного Прибалхашья очень похожего на D. polymorpha aralensis и D. obtusecarinata из Аральского бассейна и, вероятно, связанного с ними филогенетически ставит под сомнение датировку проникновения всех дрейссен апшероном. Скорее всего, балхашская и часть аральских дрейссен являются потомками Dreissena polymorpha, обитавшей в более древнее время в водных массах, покрывавших территорию от Арала до Балхаша. Потомки пресноводной D. polymorpha, осваивая более осолоненные воды дают D. polymorpha aralensis, из которого по мере преодоления олигогалинного барьера 3–5 ‰ формируется D. obtusecarinata. Адаптация к освоению во многом одинаковых экологических ниш, различающихся в основном только соленостью воды, оставляет много общих морфологических признаков, обуславливая значительное сходство дрейссен. Наличие соленостного барьера исключало обратное возвращение D. obtusecarinata в пресную воду. Сгонно-нагонные явления и течения способствовали проникновению личинок в планктонный период жизни по обе стороны барьера и, возможно, формированию небольшой зоны совместного обитания в приустьевых районах.
D. caspia, вероятно, вселяется в Арал позднее, как указывают З. Иззатуллаев и Я.И. Старобогатов (1991) в апшеронское время и формирует, осваивая осолоненные воды Арала, подвид D. caspia pallasi, отличающийся по ряду признаков от номинативного каспийского подвида D. c. caspia.
После формирования современного Аральского моря дрейссены заселяли водоем в соответствии со своими соленостными требованиями, занимая сходные ниши, и эволюционировали в пределах определенных градиентов солености как элементы эпифауны. Так, оптимальные соленостные границы по данным эксперимента для D. p. aralensis 1–5 ‰ (Андреева, Андреев, 1988), для D. obtusecarinata — 5.0–12.3 ‰ (Хусаинова, 1958), для D. c. pallasi — 7–27 ‰ (Карпевич, 1975; Андреева, Андреев, 1988).
Позднее на основе синтеза экспериментальных данных и наблюдений в природе было выявлено, что обитание дрейссен в Аральском море четко разграничено соленостными барьерами (Андреев, Андреева, 1998а). Верхней границей распространения D. p. aralensis в пределах Аральского моря являлся олигогалинный барьер 3–5 ‰, D. obtusecarinata – мезогалинный барьер 12–14 ‰, D. c. pallasi – эугалинный барьер 24–28 ‰. Выпадение дрейссен из фауны моря при его осолонении проходило в близких пределах.
На основании обособления ареала D. obtusecarinata соленостными барьерами еще раз следует отметить (см. глава 8), что ее необходимо рассматривать как самостоятельный вид, а не подвид D. polymorpha, поскольку первая барьерная соленость 3–5 ‰ (олигогалинный барьер) очень важна именно для моллюсков. Этой барьерной соленостью отсекаются все пресноводные (s. str.) моллюски, для ее преодоления, вероятно, необходима кардинальная перестройка осморегуляторной системы. Выше этого барьера солености в море развивалась специфическая олигогалинная аральская малакофауна, отсутствовавшая в сопредельных водоемах.
Интересно, что и в Каспийском море еще в начале двадцатого столетия обитал подобный по соленостной толерантности ряд дрейссен: пресноводная Dr. p. polymorpha и солоноватоводные Dr. p. andrusovi и Dr. caspia (Старобогатов, Ситникова, 1992). При этом соленость в местах обитания каспийских дрейссен колебалась в пределах: Dr. p. polymorpha – 0–2 ‰, Dr. p. andrusovi – 4.5–10.9 ‰, (Карпевич, 1947).
К высказанным ранее предположениям (Старобогатов, Ситникова, 1992; Старобогатов, Андреева, 1994) об эволюции D. caspia можно добавить, что формирование этого вида осуществлялось в условиях преодоления двух соленостных барьеров: олигогалинного и мезогалинного барьеров, имеющих в Каспии по сравнению с Аралом в силу специфики ионного состава вод меньшие абсолютные значения. А поскольку мезогалинный барьер является одновременно и хорогалинной зоной, то при солености, превышающей этот барьер, получают преимущество эвригалинные виды морского происхождения. Следовательно, формирование D. caspia и ее существование было возможным только в условиях изоляции от вод полносоленых морей и океана. Это предположение подтверждается вселением в Каспий Mytilaster lineatus (Gmel.), эвригалинного вида морского происхождения со сходными с Dreissena требованиями к субстрату, приведшего по данным Б.М. Логвиненко (1965) к вымиранию D. caspia. D. p. andrusovi был оттеснен внедрением Mytilaster в районы с пониженной соленостью. Причем ареал Mytilaster в Северном Каспии по данным А.Ф. Карпевич (1975) претерпевал существенные подвижки, обусловленные перемещением изогалины 10 ‰ при различном объеме стока. Обсуждая эволюционный ряд D. p. polymorpha, D. p. andrusovi и D. caspia, Я.И. Старобогатов и Т.Я. Ситникова (1992) отмечают, что D. p. andrusovi сохранился в Северном Каспии при соленостях недоступных конкурентам.
Итак, распространение дрейссен при отсутствии конкурентов определяется возможностями их соленостных адаптаций. Освоение сходных лицензий, различающихся только градиентами солености, дрейссенами Арала оставляет много общих морфологических признаков. Поэтому совершенствование осморегуляторного механизма в процессе проникновении из пресных вод в соленые, скорее всего, следует рассматривать как морфофункциональные преобразования арогенного ранга, слабо затрагивающие морфологию раковины дрейссен.
Моллюски рода Hypanis проникли в Аральскую котловину по данным З. Иззатуллаева и Я.И. Старобогатов (1991) в апшеронское время. После заполнения Аральской котловины водой эволюционируют, осваивая различные по механическому составу грунты. Обитание внутри грунта определенного механического состава требовало специфических адаптаций, в том числе и разных типов строения раковин, различающихся по толщине и выпуклости створок, величине апикального угла и другим признакам. Градиенты солености в случае с Hypanis почти не имели значения, поскольку вся акватория Арала, за исключением приустьевых районов и култуков, в соленостном отношении была благоприятна для них, представляя собой единые олигогалинные водные массы. Тем более что по данным Н.З. Хусаиновой (1958) границы выживания аральских гипанисов лежали в пределах солености 4.8–14.0 ‰, по данным А.Ф. Карпевич (1953) — 6–16 ‰.
Адаптивная радиация этих моллюсков сопровождалась формированием таксонов, принадлежащих к разным жизненным формам: Hypanis vitrea bergi – жизненная форма песчаных грунтов, H. sidorovi – илистых грунтов, H. minima minima – илисто-песчаных и илисто-ракушечных грунтов.
В силу своего формирования в пределах олигогалинной водной массы, не обладая физиологическими механизмами, обеспечивающими обитание, а главное размножение, при более высоких соленостях, Hypanis оказались не способными преодолеть барьер критической солености 12–14 ‰., и после осолонение моря более 14 ‰ выпали из фауны.
Первоначальным изолирующим барьером для Cerastoderma, вероятно, следует считать градиент солености, по которому были разделены до конца 1960-х годов популяции C. rhomboides rhomboides и C. isthmicum.
Обитая в открытом море в условиях жесткого биотического окружении при незначительном числе биотопов (илистые пески, песчанистые илы и илы с ракушей) C. r. rhomboides имел серьезную конкуренцию со стороны доминантов-фильтраторов Dreissena и Hypanis. Вероятно, моллюски рода Hypanis – фильтраторы, использующие сходные пищевые ресурсы, обладая плоской раковиной, были более приспособлены к обитанию на илистых грунтах в погруженном состоянии. Дрейссены же не позволяли осваивать нишу эпифауны, используя раковины церастодермы, возвышающиеся над поверхностью грунта, в качестве субстрата, углубляя их своим весом в ил, чем ухудшали условия дыхания и питания, буквально облепив задний, выступающий над грунтом край раковины церастодермы. Для Каспийского моря есть наблюдения А.И. Разина (Бродская, Неценгевич, 1941) за взаимоотношениями церастодермы и митилястера [Mytilaster lineatus (Gmel.)], ведущего сходный с дрейссенами образ жизни. Митилястер, поселяясь на раковинах церастодерм, оплетал биссусом сифоны последних, приводя их к гибели.
Обилие макрофитов, распространенных на большей части акватории Аральского моря – субстрата для дрейссен – давало также преимущества в развитии дрейссенам. Эти факторы лимитировали увеличение численности C. r. rhomboides, ограничивая его в рамках малочисленного вида инфауны Аральского моря.
Итак, жесткий ценотический контроль со стороны Hypanis не давал возможности C. r. rhomboides наращивать численность в грунте, а со стороны Dreissena отметал все попытки выйти на поверхность грунта, тем самым оставляя C. r. rhomboides в рамках вида с низкой численностью и биомассой, что и позволило С.В. Аверинцеву (1936) говорить о вымирании сердцевидок в Арале. Повышенная соленость култуков способствовала поддержанию довольно высокой численности C. isthmicum (Хусаинова, 1958), ограничивая его распространение осолоненными районами.
Подвергаясь воздействию различной солености в процессе своего исторического развития в култуках Аральского моря C. isthmicum cформировал достаточно эвригалинную популяцию, которая могла являться резервом заселения моря при его осолонении. Преобладание же в култуках песчаных грунтов способствовало формированию морфофункционального типа Cerastoderma, обладающих шаровидной раковиной с коротким задним краем, закапывающихся в грунт, а сгонно-нагонные явления, во время которых нам нередко приходилось наблюдать почти полное осушение дна больших прибрежных участков моря на длительное время (иногда более суток), содействовали его закреплению. Вот почему в открытом море в первые годы экспансии C. isthmicum, имел округлые створки раковин или же с немного удлиненным задним краем, полностью погруженные в грунт. Во второй же половине 1970-х годов в прибрежье и особенно в более осолоненных заливах, где резко снизилась численность дрейссены, наблюдалось большее разнообразие контуров створок. Добавились условно равноплечие раковины и с удлиненным задним краем. Все они также были погружены полностью в грунт, лишь у единиц задний край раковины немного возвышался над грунтом, превращаясь в субстрат для оседания дрейссен. Так, в выборке из прибрежья острова Толмачева (май 1976 г.) насчитывалось всего лишь 8 % моллюсков с немного возвышающимся над грунтом краем раковины.
По мере снижения численности дрейссен часть моллюсков получила возможность к выходу на поверхность грунта, за счет освобождения ниши неподвижных сестонофагов. Для церастодерм обозначились три направления выживания. Первое – сохранение типичной округлой формы, приспособленной к обитанию на твердых грунтах и в зоне интенсивной волновой деятельности. Второе – выход на поверхность грунта при смене стратегии питания. Третье – обитание в жидких илах открытого моря. На наш взгляд обитание в жидких илах требует более или менее уплощенной раковины с центральным положением макушек. Такая группа условно равноплечих моллюсков прослеживалась в сборах по 1989 г. включительно и выпала в связи с резким изменением характера грунтов.
Выход церастодерм на поверхность грунта сопровождался значительными перестройками морфологии раковин. Для устойчивого положения на грунте моллюску необходимо три точки опоры, что достигается смещением макушек к переднему краю раковины и уменьшением выпуклости переднего края. Чем ближе к переднему краю расположены макушки, тем менее моллюск погружен в грунт. В последние годы наблюдений (1993–1994) моллюски на илистых грунтах возвышались над грунтом более чем на 2/3–4/5 длины раковины. Линия погружения определялась высотой наилка – наиболее жидкой фракции грунта. Опираясь на макушки и раскрытые створки, моллюск занимал максимально возможное по высоте положение над грунтом. Следует отметить, что это положение крайне неустойчиво и возможно только при раскрытых створках раковины. При приближении аквалангиста моллюск захлопывает створки и падает на бок, так как при закрытых створках не может удерживаться в вертикальном положении.
Начиная с 1990 г., по материалам стандартной сетки станций, доля моллюсков полностью погруженных в грунт не превышала 28 %, а заглубленных менее чем на треть длины раковины было более 50 % выборки. На отдельных станциях все моллюски находились над грунтом, заглубляясь не более чем на 1/5 длины раковины.
Одновременно у ряда особей наблюдалось усиленное развитие сифонов, о чем свидетельствует расширение в разной степени мантийной линии от отпечатка заднего мускула-замыкателя до брюшной части мантийной линии (в области сифонов). В выборке из прибрежья острова Толмачева (1976 г.) доля таких особей составила 24.2 %, на станции 1 (1976 г.) – 90 %, в размерной группе более 14 мм из залива Сары-Чаганак 1979 г. – 47.2 %, в то время как у эталонных экземпляров 1976 г. из открытого моря и моллюсков из сборов Л.С. Берга 1901-1902 гг. мантийная линия не расширена.
В сборах 1989–1990 гг. расширение мантийной линии в области сифонов отмечено у 72.4 % выборки, причем у моллюсков с округлым контуром створок расширения мантийной линии не отмечено. У моллюсков с немного удлиненным задним краем раковины мантийная линия расширена в 60 % случаев, с удлиненным задним краем раковины – в 71.4 %, с очень удлиненным задним краем раковины и с очень удлиненным задним краем раковины и смещенными макушками – в 85.7 %. Для Cerastoderma со станции у входа в залив Бутакова в 1994 г. при погружении в грунт более чем на 1/3 длины раковины мантийная линия расширена у 75 %, менее чем на 1/3 –у всех особей.
Таким образом, за 1976–1994 гг. у Cerastoderma Аральского моря наблюдалось возрастание доли особей в популяции с расширенной в области сифонов мантийной линией, причем расширение мантийной линии в области сифонов в последние годы наблюдается преимущественно у особей с удлиненным задним краем раковины, наименее заглубленных в грунт. За этот период произошло формирование нового морфофункционального типа (жизненной формы) при перемещении части популяции Cerastoderma из грунта на его поверхность (практически превращение компонента инфауны в компонент эпифауны), сопровождаемого удлинением заднего края раковины и расширением мантийной линии в области сифонов.
За этот же период времени произошло уменьшение доли особей Cerastoderma с симметричными раковинами и увеличение – с зияющими раковинами. Так, для выборки 1976 г. в целом моллюсков с симметричными раковинами насчитывалось 70.6 %, в 1990 – 25.9 %, в 1994 – 45.2 %.. Зияющие раковины в 1976 г. встречались единично, в 1990 г. – 32.7 %, в 1994 г. – 63.7 %, причем на отдельных станциях число особей с зияющими раковинами могло существенно превышать среднюю выборки. Так, на станции 1 в 1976 г. особей с зияющими раковинами было – 66.7 %, в заливе Бутакова в 1993 г. – 91.7 %.
Особо следует рассмотреть эволюцию замка Cerastoderma в 1976–1994 гг. в Аральском море. Многообразие и изменчивость замковых аппаратов свидетельствует о том, что отбор идет не по линии замка в узком смысле. Отбор направлен на освоение новой для Cerastoderma ниши эпифауны: на размещение как можно выше сифонов над грунтом. Для чего последовало изменение конфигурации раковины с целью придания ей устойчивого положения и ее облегчения, то есть уменьшения массы раковины за счет утончения створок и облегчения спинного края двояким путем:
1. За счет ослабления (утончения) зубов до полной редукции некоторых с одновременным удлинением и сегментацией лигамента вплоть до четкообразного и формированием переднего лигамента. Причем наблюдались все варианты изменчивости (перехода) от типичного замка до замка с полной редукцией отдельных зубов, в частности ярко выраженный переход по первому заднему латеральному зубу.
2. За счет замены известкового замка замком с чередованием слоев конхиолина и кальция и дополнительного упрочнения замка путем «прошивания» створок в области замочной площадки многочисленными конхиолиновыми тяжами-нитями, покрывающими словно слоем мха все элементы замочной площадки и препятствующие раскрытию створок. Возможно, это начальная стадия формирования внутреннего лигамента, сопровождаемая удлинением и сегментацией наружного. Параллельно наблюдается сглаживание – (размывание) выступающих элементов замка, редукция зубов и образование менее выступающих, чем зубы в норме, дополнительных зубовидных образований на нимфе и замочной площадке в области кардинальных зубов – возврат (?) к примитивному предковому равнозубому замку.
Наши наблюдения за изменением замка, положением макушек и конфигурацией створок согласуются с выводами В.В. Анистратенко (1987), указывающего, что у пресноводных двустворок строение зубной системы и положение макушек взаимозависимы, обеспечивая нарастание раковины единственно возможным путем, и связаны с физической характеристикой среды обитания, к которой приспособлен каждый вид моллюсков
Итак, к началу 1990-х годов в Аральском море сформировались группы Cerastoderma, существенно отличающиеся контуром створок раковины, выпуклостью раковины, степенью заглубления раковины в грунт, строением лигамента и замка, расширением мантийной линии в области сифонов, положением более выраженного ребра, общим числом ребер и числом нормально развитых ребер, морфометрическими индексами.
Сравнение контрольных выборок (прибрежье острова Толмачева, май 1976 г.; прибрежье залива Сары-Чаганак, 1989 г.; залив Тщебас, 1992 г.; станция 18 в заливе Бутакова, 1993 г.; район станции 11, 1994 г.; вход в залив Бутакова, 1994 г.) дает наглядное представление о направлении и темпах эволюционного процесса Cerastoderma Аральского моря. В целом, эволюция Cerastoderma Аральского моря направлена на освоение этими моллюсками всех освобождающихся экологических ниш водоема путем формирования и отбора групп с менее выпуклой раковиной с удлиненным задним краем, облегченной за счет измененного замкового аппарата и уменьшения числа ребер. За 20–25 лет здесь сформировались формы, расходящиеся по ряду признаков (см. глава 6).
Сравнивая за 1976–1994 гг. выборки обитающих в грунте моллюсков с типичным для C. isthmicum округлым контуром, следует отметить изменение морфометрических индексов. Раковины в выборке 1994 г. по сравнению с эталонными 1976 г. достоверно менее выпуклы и имеют более удлиненный лигамент с более длинной выпуклой частью (см. табл. 6.9). Изменилась и скульптура створок: наблюдается уменьшение общего числа ребер и нормально развитых ребер (рис. 9.2).
<![if !vml]>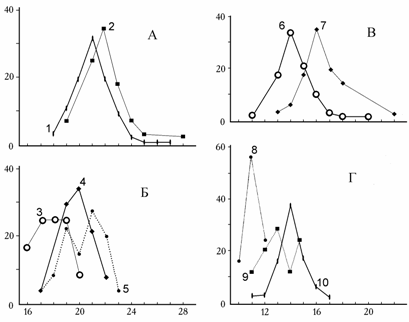 <![endif]>
<![endif]>
Рис. 9.2. Распределение общего числа ребер (А, Б) и числа нормально развитых ребер (В, Г) на раковинах Cerastoderma (по: Андреева, 2000б).
1, 6 – залива Сары-Чаганак, 1979 г.; 2, 7 – прибрежья о. Толмачева, 1976 г.; 3, 8 – залива Бутакова, 1993 г.; 4, 9 – входа в залив Бутакова, 1994 г.;5, 10 – станции 11 (песок), 1994г. По оси абсцисс – число ребер, по оси ординат – процент от общего числа особей в выборке.
При сравнении Cerastoderma заливов Тщебас, Бутакова и из района входа в залив Бутакова, имеющих удлиненно-овальную, анадонтоподобную и обратно мидиеподобную раковину с Cerastoderma с округлым контуром раковины выявлено, что значения ряда морфометрических индексов не перекрываются (см. табл. 6.9). Cerastoderma заливов Тщебас и Бутакова, анадонтоподобные и обратно мидиеподобные из района входа в залив Бутакова имеют уплощенные, длинные с вытянутым задним краем раковины со смещенными вперед макушками, длинным лигаментом и меньшим числом ребер вообще и нормально развитых в частности. При сближении между собой по ряду морфометрических индексов эти группы моллюсков отличаются вполне достоверно по выпуклости раковин и величине отношения длины макушек к длине лигамента, а также контурами раковин (Андреева, 2000б).
Итак, при сравнении выборок Cerastoderma в ретроспективном плане зарегистрировано изменение основных морфометрических индексов и счетных признаков для моллюсков с типичными контурами раковин – обитателей песчаного грунта, а также вычленение уклоняющихся групп, обитающих вне грунта. То есть, при катастрофическом изменении экосистемы моря выявлены отклонения фенотипических признаков, превышающих норму реакции вида, что свидетельствует о коренной перестройке генофонда Cerastoderma Аральского моря. Появились популяции с размахом вариаций по многим признакам, превышающим межвидовые для Cerastoderma, в частности, указанные для азово-черноморских и олигоценовых из Приаралья видов рода (Скарлато, Старобогатов, 1972; Мерклин, 1974). Причина возможности яркого проявления эволюционного процесса и увеличения его темпов – изменение биоты Арала вследствие его усыхания (вымирания солоноватоводных видов) и акклиматизации беспозвоночных. Пусковой механизм ускорения эволюционного процесса – переход всей экосистемы моря через мезогалинный барьер (зону критической солености) 12–14 ‰ к концу 1970-х годов и эугалинный барьер 24–28 ‰ в конце 1980-х годов.
С позиций концепции критической солености (Хлебович, 1974) с поправкой на положение хорогалинной зоны в Аральском море объяснимо обитание C. isthmicum в прибрежных осолоненных районах и култуках до начала осолонения моря. Частичное воздействие критической и барьерной солености на биоту Арала, имевшее место в култуках, не давало подобного эффекта лишь потому, что основная акватория моря находилась вне этих зон и сформировавшиеся отклонения отметались стабилизирующим отбором при проникновении их в море, а сами зоны были незначительны по объему и недолговечны вследствие сгонно-нагонных явлений, в результате которых происходило перемешивание и смещение водных масс с различной соленостью.
В целом, C. isthmicum Арала способен выдерживать широкий спектр изменения солености с понижением ряда жизненных функций в зоне критической солености (Андреев, Андреева, 1990б) вследствие формирования рода в условиях моря и последующего расселения в солоноватые и соленые водоемы (Скарлато, Старобогатов, 1972; Старобогатов, 1970, 1974). Однако массированное воздействие на популяцию критической солености привело к взрыву изменчивости.
Нахождение яйцеклеток и активация сперматозоидов в агрессивной среде (мезогалинный барьер) приводили к различным отклонениям, а развитие оплодотворенной яйцеклетки (зиготы) в агрессивной среде вело к увеличению уродств, снижению выживаемости молоди и более старших возрастных групп. Выжившие моллюски развивались далее в условиях далеких от оптимальных для вида, о чем свидетельствует процент уродливых особей в выборках.
Принимая во внимание наличие пелагической стадии в жизненном цикле Cerastoderma, перемещающейся на десятки километров за планктонный отрезок жизненного цикла и численность этой стадии (численность личинок Cerastoderma и Syndosmya в 1981 г. достигала 20832 экз./м3, а в мае 1992 г. – 110034 экз./м3 (Андреев, 1989, 1999), следует отметить колоссальные возможности для расселения редких генотипов, возможности их поддержания и размножения в составе популяций.
Таким образом, генофонд Cerastoderma второй половины 1970-х годов обладал большим запасом изменчивости. В это же время происходило снижение численности как промысловых, так и непромысловых рыб Арала (Андреев и др., 1995; Андреев, 1999) – потребителей церастодермы на пелагической и донной стадиях жизненного цикла с одной стороны и накопление резервов органики на дне водоема с другой. Огромные пространства дна Аральского моря в середине 1970-х годов были покрыты толстым войлоком остатков нитчатых водорослей, затруднявших нам разборку проб зообентоса, и дополнявших накопленные ранее в толще грунта недоиспользуемые, по мнению А.Ф. Карпевич (1975), запасы органики.
Итак, во второй половине 1970-х годов в Аральском море сложились условия, способствующие выживанию (снижение численности потребителей-рыб) и прокормлению всех переживших критическую соленость особей церастодермы. К этому же периоду относится резкое повышение количественного развития этого вида как в среднем по морю, так и по отдельным зонам, свидетельствующее о вероятном увеличении численности вновь возникающих генотипов.
Наличие в море такого элемента эпифауны как дрейссена в течение всей современной истории Арала было ограничивающим фактором для церастодермы на выход в малейшей степени из грунта. Дрейссены до второй половины 1960-х годов были в составе доминирующих видов зообентоса. На любой выступающий субстрат происходило оседание личинок дрейссен и по мере их развития и роста ухудшались условия дыхания и питания для живых субстратов, вследствие чего при наличии дрейссен в море невозможен был даже частичный подъем раковины других видов моллюсков над грунтом. Во второй половине 1970-х годов при прогрессирующем осолонении моря Dreissena obtusecarinata сменяет малочисленный ранее вид Dreissena caspia pallasi и наблюдается вспышка его численности, при этом биомасса дрейссен достигала в среднем по морю 3.5–4.8 г/м2 (Андреева, 1989).
Разновременный переход отдельных районов моря через зону критической солености (мезогалинный барьер), в силу различной скорости процесса их осолонения, способствовал постоянному увеличению ненаправленной изменчивости, поставляющей материал для отбора. Вполне возможно, что потомки моллюсков, впервые размножавшихся в этой зоне, могли последовательно несколько раз размножаться в зоне критической солености по мере их расселения по акватории водоема и повышения там солености вод до критической.
В конце 1970-х годов отбор все еще был направлен на обитание церастодермы в грунте, хотя и происходит дифференциация аральской популяции церастодермы по отношению к грунтам. Наблюдается вычленение условно равноплечей уплощенной формы на жидких илистых грунтах и формы с удлиненным задним краем – переходных от овальной, шарообразно вздутой к уплощенным.
Выпадение Dr. c. pallasi после 1982 г. явилось существенным этапом в эволюции аральских Cerastoderma. В результате снятия этого ограничивающего фактора стал возможным выход церастодерм из грунта, тем более что в грунте они стали испытывать жесткий прессинг со стороны Syndosmya, обитающей в исходном ареале в условиях насыщенной биоты и адаптированной к подобным факторам. В 1991 г. была зарегистрирована максимальная средняя биомасса синдосмии для Арала – 235 г/м2, а ранее в заливе Бутакова средняя – 496.7 г/м2 при максимальной – 814.0 г/м2. Максимальная численность синдосмии на отдельных станциях в 1990 г. достигала 26560 экз./м2 при биомассе 701.2 г/м2, церастодермы на этой же станции – 2840 экз./м2 при биомассе 175.2 г/м2 (Андреев, Андреева, 1991а).
Перерыв в исследованиях (1983–1988 гг.) не позволяет точно датировать массовый выход церастодермы из грунта. При возобновлении исследований в 1989 г. отмечено увеличение изменчивости контуров раковин и количества контуров с удлиненным задним краем. Многие из них, судя по обрастаниям на раковинах, уже находились над грунтом.
1989 г. резко отличается по своим гидролого-гидрохимическим условиям от конца 1970-х – начала 1980-х годов. Помимо возрастания общей солености воды именно на конец 1980-х относится серьезная перестройка солевой системы моря вследствие седиментации карбонатов кальция, магния и гипса (Лобов с соавт., 1995). Летом 1989 г. на поверхности грунта обнаруживалась корка соли, препятствовавшая работе дночерпателя. На заднем конце раковин церастодерм, обитавших между 12 и 9 станциями в 1989 г. в Малом море, имеются крупные кристаллы соли, образующие толстое (до 3 мм) пятно на выступающем над грунтом краю раковины. Это косвенные свидетельства трагедии, постигшей инфауну Арала, возможно, уже в 1987–1988 гг. Оседающие соли, образуя корку, делали невозможным существование в грунте многих организмов бентоса на обширных участках дна. Но продукционные процессы в толще воды продолжались и на корку солей происходила седиментация органики и развивался наилок, в котором могла существовать осевшая молодь от размножения Cerastoderma из других районов моря, где процесс метаморфизации запаздывал. Наличие над коркой соли слоя наилка в 1–1.5 см, позволяло существовать особям церастодермы, фильтруя из придонных слоев воды.
После вымирания подвижных и неподвижных сестонофагов Cerastoderma оказались единственной формой в Аральском море способным заполнить освободившуюся арену жизни. При этом давление отбора было направлено на максимально возможный выход этих моллюсков из грунта.
Постепенно формируется совершенно особая жизненная форма моллюсков, не свойственная фауне Арала при его квазистационарном режиме. Эта жизненная форма обладает комплексом особых морфоэкологических адаптаций, как-то облегченная раковина с удлиненным задним краем, интенсивно развитые сифоны и пр., возникших в результате давления отбора при освоении новой арены жизни.
В настоящее время существуют различные концепции понятия «жизненная форма» (Шарова, Свешников, 1988). В данной работе принимается определение «жизненной формы» И.Х. Шаровой (1981) как «совокупности организмов, занимающих общую экологическую нишу, с комплексом сходных морфологических признаков, возникших в процессе эволюции под влиянием сходных факторов естественного отбора» (с. 23).
Исходя из этого определения, можно утверждать, что в конце 1980-х годов в Аральском море одновременно существовали три жизненные формы Cerastoderma на бентосной стадии жизненного цикла, достаточно ясно различающиеся как по ряду морфологических признаков и поведенческих адаптаций, так и по месту обитания.
Жизненная форма, обитающая в песчаном грунте, внешне сходная с эталонными C. isthmicum 1976 г. Это моллюски с сильно вздутой округлой раковиной с широкими макушками несколько смещенными вперед. Всего ребер 19–21, нормальных — 13–16. Отношение высоты раковины к ее длине составляло 0.98±0.09; отношение выпуклости раковины к ее длине — 0.72±0.02; отношение выпуклости раковины к ее высоте — 0.74±0.06.
Эти моллюски с округлым контуром створок раковин остаются погруженными в грунт, сохраняя и внешний облик и образ жизни, свойственный C. isthmicum Аральского моря, в силу двух причин:
1. Это обитание в зоне песчаных грунтов, формирующихся и обычно расположенных в зоне активной волновой деятельности. Перемещение водных масс не способствует отбору на выход моллюсков из грунта, так как положение на грунте при опоре на макушки, передний край раковины и ногу даже при небольшом заглублении в грунт все-таки мало устойчиво, а перекатывание моллюска волнами по дну не является благоприятным фактором для его жизнедеятельности. Итак, волнение в зоне отложения песчаных грунтов – фактор, действующий в сторону отбора особей, зарывающихся в грунт.
2. Биотическое окружение на подобного типа грунтах не оказывает такого давления на Cerastoderma как на илисто-песчаных и илистых в силу слабого количественного развития других представителей инфауны. В частности, в прибрежных биоценозах, развивающихся на песках крайне низка численность Syndosmya по сравнению с биоценозами, занимающими илистые грунты (Андреева, Андреев, 1990а). Прибрежные песчаные грунты остаются биотопом, где наибольшие преимущества имеют Cerastoderma с округлой, толстостенной раковиной, погруженной в грунт, где и сохраняются моллюски внешне близкие к типовым C. isthmucum 1976 г., но резко отличающиеся от них по ряду признаков, главнейшие из которых строение замка, лигамента, число ребер на створках и окраска раковины.
Жизненная форма, обитающая в жидком илистом грунте. Это моллюски с уплощенной раковиной, обладающей удлиненно-округлыми или овальными створками с центральным положением макушек (условно равноплечий контур). Макушки у моллюсков в разные годы исследований могут быть как довольно широкими, так и узкими. Всего ребер 19–23, нормальных — 11–19. Отношение высоты раковины к ее длине составляло 0.88±0.01; отношение выпуклости раковины к ее длине — 0.62±0.01; отношение выпуклости раковины к ее высоте — 0.70±0.01.
Эта жизненная форма илистых грунтов не встречена в сборах после 1989 г.
Эпифаунистическая жизненная форма, обитающая на песчано-илистом или илисто-ракушечном грунте и располагающаяся преимущественно вне грунта (Андреев, Андреева, 1995б, 1997б). У представителей этой жизненной формы изменилось видоспецифическое поведение. Известно, что Cerastoderma Аральского, Каспийского и Черного морей (Хусаинова, 1958; Нейферт, 1967; Романова, 1979) находились в грунте и питались, взмучивая и «сдувая» частицы органики с поверхности грунта. Эти же моллюски вышли на поверхность грунта и фильтруют, как и дрейссены, из водной толщи (рис. 9.3). Данная чрезвычайно полиморфная группа моллюсков включает целый букет форм, ряд из которых прослеживается в бентосе различных районов Аральского моря при совместном обитании в течение нескольких лет.
Общим для них является наличие в разной степени уплощенной раковины с очень вытянутым задним краем и сильно смещенными вперед макушками, а также преобразование в различной степени лигамента. Лигамент удлиняется и расчленяется вплоть до четковидного, наряду с типичным для Cerastoderma задним лигаментом может формироваться передний лигамент, обычно состоящий только из слоя слияния, но в ряде случаев имеющий типичное трехслойное строение. В целом, эти моллюски имеют меньшее число ребер, чем моллюски других жизненных форм (общее число ребер от 14 до 22, нормально развитых от 9 до 16). Значения морфометрических индексов в целом отличаются от таковых моллюсков других жизненных форм и имеют значительный размах колебаний, что обусловлено объединением в одну жизненную форму букета достаточно различающихся между собой форм моллюсков (см. глава 6). Эти формы обладают рядом различных жизненно важных морфологических признаков (адаптаций), имеющих систематическое значение для двустворчатых моллюсков, и различаются между собой в большей степени, чем современные виды Cerastoderma Черного моря. Причем, не сходны между собой как формы географически изолированные, обитающие в Малом или Большом море, так и формы совместно обитающие, отловленные на небольшом участке акватории, что, по-видимому, позволяет говорить о видообразовательном процессе среди Cerastoderma Аральского моря.
Итак, как уже отмечалось выше, вымирание дрейссен и экспансия Syndosmya segmentum по акватории Арала с резким наращиванием численности и биомассы акклиматизанта на илистых и илисто-песчаных грунтах явились факторами, способствовавшими отбору части Cerastoderma на выход из грунта. Этот процесс занимал незначительный промежуток времени, так как к 1990 г. в заливе Бутакова уже сформировалась популяция существенно отличающаяся по ряду признаков от эталонных C. isthmicum 1976 г. и Cerastoderma прибрежья острова Толмачева 1976 г. По коллекциям 1976–1994 гг. имеется возможность проследить все этапы перехода от форм, обитающих в грунте, к формам, максимально находящимся на поверхности.
<![if !vml]>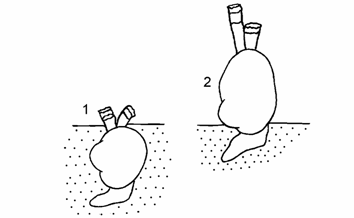 <![endif]>
<![endif]>
Рис. 9.3. Схема положения Cerastoderma в грунте Аральского моря (по: Андреев, Андреева, 1997б с исправлениями).
1 – типичное положение Cerastoderma isthmicum, 2 – положение современных Cerastoderma вне грунта.
Постепенное вымирание с середины 1970-х годов всех сестонофагов, как инфауны, так и эпифауны, за исключением Cerastoderma, а также переход экосистемы Арала от макрофитного типа продуцирования органического вещества к микрофитному (за счет фито- и бактериопланктона, микрофитобентоса) стимулировали адаптивную радиацию Cerastorerma (рис. 9.4).
Процесс видообразования среди Cerastoderma как Малого, так и Большого моря и протекал параллельно. Наблюдается общая канализированность процесса, направленного на выход моллюсков из грунта и освоение адаптивной зоны эпифауны. В процессе видообразования затронут ряд морфологических признаков, имеющих систематическое значение для Cerastoderma и в целом для других таксонов двустворчатых моллюсков. Одним из таких систематических признаков в морфологии раковины является строение и относительные размеры лигамента (Petersen, 1958; Boyden, 1973; Brock, 1978; и др.). В рассматриваемом случае популяции Cerastoderma Малого и Большого моря, изолированных водоемов, отличаются друг от друга строением лигамента в большей степени, чем современные виды Cerastoderma Черного моря. Так, контрольная выборка залива Тщебас 1992 г. Большого моря при внешнем сходстве контуров створок с контурами контрольных выборок из залива Бутакова 1993 г. и из входа в залив Бутакова 1994 г. Малого моря имеет существенные отличия в строении лигамента (Андреева, 2000б). Моллюски из Малого моря если и имеют продолжение лигамента впереди макушек, то оно представлено только слоем слияния. Моллюски из залива Тщебас Большого моря всегда имеют продолжение лигамента впереди макушек, причем в ряде случаев это продолжение имеет типичное для двустворчатых моллюсков трехслойное строение с формированием одной или даже двух дополнительных нимф на передней части замочной площадки. Формируется подобие амфидетного лигамента, свойственного архаичным двустворчатым моллюскам (Скарлато и др., 1990).
<![if !vml]> <![endif]>
<![endif]>
Рис. 9.4. Адаптивная радиация Cerastoderma Аральского моря (по: Андреева, 2000б).
1 – моллюски с округлой вздутой раковиной, 2 – моллюски с условно равноплечей уплощенной раковиной (вымерли); 3–8 — моллюски с удлиненным задним краем раковины и смещенными вперед макушками: 3–5 — передний лигамент состоит только из слоя слияния, 6–8 — передний лигамент типичного строения.
В сложившейся ситуации все морфологические признаки, как имеющие важное систематическое значение, так и второстепенные, вышли из-под контроля стабилизирующего отбора в такой степени, что в аральских популяциях Cerastoderma стали прослеживаться элементы архаичности, свойственные примитивным предковым двустворкам, отстоящим достаточно далеко от современных Cerastoderma. Помимо уже отмеченного амфидетного лигамента примером может служить и формирование подобия ктенодонтного замка в контрольной выборке 1994 г. из входа в залив Бутакова.
При разрушении сложившихся биотических связей, однонаправленном изменении основных абиотических факторов и в отсутствие стабилизирующего отбора наблюдается рекапитуляция архаичных признаков, что говорит о разрушении комплекса адаптивно важных признаков и приводит к существенному изменению генетической системы популяции. Наличие в контрольных выборках последних лет из различных частей Арала групп особей со столь существенными расхождениями по важнейшим для двустворок систематическим признакам указывает на взрывной процесс видообразования, затрагивающий, возможно, и макроэволюционный уровень.
Освоение новой арены жизни (прорыв в новую адаптивную зону) обычно сопровождается адаптивной радиацией. Вид, первоначально заселивший новую зону, обычно дает начало разнообразным линиям (Грант, 1980), что и наблюдалось в конце 1980-х – начале 1990-х годов на Cerastoderma в Аральском море. И, как отмечает С.С. Шварц (1980), «истинный эволюционный прогресс заключается в создании новой экологической ниши, создающей предпосылки к широкой адаптивной радиации» (с. 250). Выход в новую среду обитания стимулировал дальнейшее развитие различных адаптаций в популяциях Cerastoderma Малого и Большого моря, способствующих существованию на грунте. Разнообразие форм Cerastoderma, достаточно четко различающихся по морфологическим признакам, занявших нишу эпифауны, вероятно, свидетельствует о начавшейся специализации, основанной по мнению С.С. Шварца (1980) на ароморфных преобразованиях. И, как указывает С.С. Шварц (1980), для каждого данного вида в данной среде обитания эволюционные возможности ограничены, что совершенно справедливо для C. isthmicum, обитающего в песчаном грунте. В случае формирования эпифаунистической жизненной формы Cerastoderma наблюдается прогрессивная экспансия в различные биотопы (на илистый песок, песчанистый и ракушечный ил, ил), происходящая на основе формирования новых экологических ниш и ведущая к адаптивной радиации.
Подобный прецедент уже имел место в истории морских водоемов (Невесская с соавт., 1989; Старобогатов, 1994). При освоении пережившими кризис эвригалинными видами и их непосредственными потомками чуждых им ранее экологических ниш [= создание новых экологических ниш по С.С. Щварцу (1980)], наблюдались морфологические изменения, приводившие к становлению видов, сходных с экологически близкими видами. Так, некоторые Dreissenidae перешли к жизни в грунте и по форме раковины стали напоминать некоторых инфаунных двустворок. Вероятно, среди Cerastoderma Аральского моря при его современной регрессии наблюдаются процессы, тождественные, скорее всего, процессам, имевшим место в геологическом прошлом водоемов нашей планеты.
Почему стало возможным освоение Cerastoderma новой адаптивной зоны и, самое главное, почему стала возможной адаптивная радиация? Ответ на этот вопрос следует искать исходя из экоцентрической концепции эволюции. Ее основной постулат гласит, что ни одна видовая популяция не может существовать вне экосистемы (Старобогатов, 1987), и ключевым камнем в этой ситуации является перестройка, эволюция экосистемы Аральского моря, заключающаяся в изменении направления трансформации вещества и потока энергии. В период квазистационарного режима основным поставщиком первичного органического вещества в Аральском море являлись макрофиты. В конце 1980?х – начале 1990-х годов ситуация в корне изменилась. Первенство в продуцировании первичного органического вещества перешло к фито- и бактериопланктону и, частично, к микрофито- и бактериобентосу. При этом произошло существенное ( примерно на порядок) возрастание скорости первичного продуцирования (Орлова, 1993), за счет увеличения содержания биогенных элементов в водной толще (Свиридова, 1990). Существенное возрастание скорости первичного продуцирования в водной толще могло, по-видимому, обеспечить формирование достаточно мощной пастбищной пищевой цепи, тем самым изменив направление потока энергии.
Итак, к концу 1980-х годов в экосистеме Аральского моря оказались вакантными лицензии в понимании Я.И. Старобогатова и В.В. Левченко (Левченко, 1984; Старобогатов, 1984, 1985, 1988; Левченко, Старобогатов, 1986, 1990), занимаемые ранее моллюсками рода Dreissena, плюс ко всему почти на порядок возросшая скорость продуцирования первичного органического вещества в водной толще стимулировала возможность «открытия» новых лицензий для фильтраторов. А поскольку для жизни, размножения и эволюции наибольшее значение имеют пища и пищевые связи (Шмальгаузен, 1983), то совокупность этих возможностей и «спровоцировала» не только выход на поверхность грунта Cerastoderma, но и адаптивную радиацию внутри группы. Тем более, что трофический фактор определяет распределение двустворчатых моллюсков по дну водоема (Кузнецов, 1979, 1980).
Таким образом, повышение солености и снижение численности и биомассы представителей инфауны предоставили возможность к расселению C. isthmicum по всей акватории моря. Переход экосистемой моря через зону критической солености вызвал взрыв изменчивости и формирование жизненной формы Cerastoderma для илистых грунтов, вымершей в конце 1980-х – начале 1990-х годов. Дальнейшее ослабление ценотического контроля при вымирании эпифаунистических моллюсков и преодоление барьерной солености спровоцировали постепенный выход Cerastoderma на поверхность грунта с формированием букета «видов» in stati nascendi в пределах эпифаунистической жизненной формы.
Градиенты солености для эволюции Cerastoderma, практически не имели значения, так как находились в пределах толерантного диапазона, за исключением периодов преодоления критической и барьерной соленостей, когда происходило увеличение амплитуды изменчивости, вследствие вероятного возрастания темпов мутационного процесса.
Имеющиеся материалы по Cerastoderma Аральского моря (по 1994 г. включительно) относятся к начальным этапам взрыва видообразования и дальнейшая судьба возникших форм (групп) зависит от дальнейшей эволюции экосистемы Арала.
Эволюция экосистемы Большого моря с 1961 г. была сопряжена и подчинена прогрессирующему осолонению. Вероятно и дальнейшее осолонение Большого моря вплоть до формирования нескольких остаточных гипергалинных водоемов. Существование Cerastoderma в условиях повышающейся солености будет определяться солеустойчивостью формирующихся видов. Возможно, что наряду с отбором на выход из грунта параллельно происходит и отбор на формирование большей солеустойчивости. В условиях эксперимента аральские Cerastoderma начала 1990-х годов аклимировались до солености 80–90 г/л (Филиппов, 1995; Filippov, Komendantov, 1996). Возможно, что более низкие данные по солеустойчивости Cerastoderma Аральского моря, полученные в предыдущие годы (Хусаинова, 1958; Андреев, Андреева, 1990б), объясняются изменениями генофонда.
Эволюция экосистемы Малого моря до отделения его от Большого моря происходила синхронно, причем Малое море в процессе осолонения даже опережало Большое море. После разделения морей небольшого количества вод, поступающих по Сырдарье, стало достаточным для того чтобы осолонение Малого моря остановилось и даже началось небольшое распреснение, чему способствовало и строительство временных дамб в проливе Берга. Очевидно, соленость вод Малого моря будет претерпевать довольно значительные колебания в зависимости от объема стока и надежности дамбы, но, скорее всего, в ближайшие десятилетия соленость его вод будет находится в пределах толерантного диапазона Cerastoderma.
Вероятно, дальнейшая эволюция форм Cerastoderma Малого моря будет проходить при солености ниже 25 ‰ и определяться, в большей степени, биотическим окружением. Здесь большую роль могут иметь увеличение запасов бентофага акклиматизанта камбалы-глоссы, в рационе которой Cerastoderma составляют существенную долю (Андреев с соавт., 1995).
После вымирания Dreissena caspia pallasi и D. obtusecarinata дрейссены вряд ли в обозримом будущем могут иметь ограничивающее значение для Cerastoderma, так как оставшийся в бассейне Арала подвид Dreissena polymorpha aralensis – пресноводная форма, зона обитания которой ограничена низкой соленостью и не совпадает с ареалом Cerastoderma. Только после преодоления олигогалинного барьера 3–5 ‰ и формирования более солевыносливого подвида (что, вероятно, уже происходило в истории Арала неоднократно) появится возможность ценотического контроля.
Возможно, отрицательное влияние на формы, тяготеющие к илистым глубоководным биотопам, будут оказывать и расширяющиеся заморные явления в центральных котловинах.
Таким образом, выход инфаунных Cerastoderma на поверхность грунта можно рассматривать как эволюционное преобразование, на базе которого наблюдается адаптивная радиация для освоения новой для группы арены жизни. Давление отбора направлено на формирование жизненной формы, обладающей раковиной максимально возвышающейся над грунтом и специализирующейся на питании из максимально удаленных от дна слоев воды. При этом образовался букет форм, обладающих существенными морфологическими отличиями в форме, окраске и скульптуре створок и их симметрии, строении замка, лигамента, наличие зияния и пр. Достоверное значительное изменение габитуса раковин, проявление архаичных и возникновение новых морфологических признаков позволяет говорить о бурно идущем процессе видообразования, и, возможно, о формировании новых надвидовых таксонов. Судя по наблюдениям за Cerastoderma Аральского моря в условиях некогерентной фазы эволюции (Красилов, 1986) идет лишь накопление различных форм, существование многих из которых ограничено во времени. И только при вступлении водоема в фазу квазистационарного гидролого-гидрохимического режима при подключении стабилизирующего отбора в условиях обострившейся конкуренции из многообразия форм будет закончено формирование видов, соответствующих предоставленным экосистемой лицензиям.
Несомненно, что сформировавшиеся группы Cerastoderma Аральского моря заполнили и будут заполнять в дальнейшем лицензии, предоставляемые экосистемами других морей эпифаунистическим комплексам двустворчатых моллюсков.
Syndosmya были вселены в Арал из Бердянских лиманов Азовского моря в начале 1960-х годов (Карпевич, 1975). Перед интродукцией Syndosmya segmentum в Аральское море были проведены экспериментальные работы по определению ее резистентности к аральской воде (Карпевич, 1962, 1964, 1975). Было установлено, что аральская вода соленостью 10–12 ‰ пригодна для жизнедеятельности S. segmentum, однако в этой воде наблюдалось удлинение сроков эмбрионального развития, замедление роста эмбрионов и личинок по сравнению с контролем в азовской воде такой же солености. Отставание в выклеве личинок в аральской воде по сравнению с контрольной азовской составляло 4 суток, а в оседании – 5 суток. Также было отмечено, что повышенное содержание иона Ca2+ приводит к появлению у личинок синдосмии уродливых недоразвитых раковинок (Карпевич, 1964). Для другого азовского двустворчатого моллюска Lentidium mediterraneum (=Corbulomya maeotica) (Costa) в аральской воде соленостью 10–12 ‰ возможны были только начальные стадии замедленного эмбрионального развития, заканчивающиеся гибелью недоразвитых личинок (Карпевич, 1962).
Таким образом, вода Аральского моря по своему химическому составу является неблагоприятной для развития азово-черноморских двустворок, а вселение в Аральское море S. segmentum было для этого вида серьезным стрессовым фактором, вызвавшим массовую гибель вселенцев. Видимо поэтому, несмотря на целенаправленные ежегодные поиски вид был обнаружен только в 1967 г., через шесть лет после первого и через четыре лет после повторного вселения в довольно изолированный, небольшой залив Сары-Чаганак, неподалеку от места вселения, причем популяция состояла в основном из мелкоразмерных особей (Кортунова, 1970; Карпевич, 1975). Для сравнения укажем, что полихета Nereis diversicolor была обнаружена через два года после первого вселения (Кортунова, 1970). Довольно длительный латентный период для большой партии вселенца (по данным Е.Л. Марковой (1975) около 1 млн. экз.) с колоссальной энергией размножения (7–12 тыс. яиц за одно икрометание для особи среднего размера при порционном размножении) и пелагической личиночной стадией свидетельствует о не достаточно благоприятных условиях новой среды обитания.
Вдобавок следует отметить, что освоение синдосмией в начале 1960-х годов залива Сары-Чаганак происходило при солености воды несколько превышающей среднюю многолетнюю для Аральского моря. Так, по данным ГМО на станции Аральское море, расположенной в заливе Сары-Чаганак, среднегодовая соленость в 1961–1968 гг. колебалась в пределах 10.27–12.07 ‰ (Гидрометеорология ..., 1990). По данным АралКазНИИРХ соленость в месте вселения в августе 1963 г. была 11.8 ‰. В эксперименте было показано (Андреев, Андреева, 1983, 1990б), что в аральской воде соленостью 12–14 ‰ происходит достоверное снижение жизнедеятельности S. segmentum до 30–40 % на организменном и тканевом уровнях. Наиболее неблагоприятно воздействие воды соленостью 12–14 ‰ на сперматозоиды, выживаемость которых при такой солености снижалась до 25 %.
Вероятно, воздействие ионного состава на популяцию S. segmentum в первые годы после вселения являлось мощнейшим фактором, вызвавшим взрыв изменчивости. Так, анализ популяции синдосмии 1970 г. дает удивительное многообразие по ряду систематических признаков (см. глава 7). В целом материалы выборки 1970 г. выстраиваются в почти непрерывные ряды изменчивости по контуру створок раковин, форме и размеру лигамента, строению замка. Моллюски начальных, центральных и конечных звеньев ряда изменчивости по контуру створок довольно близки по габитусу к формам моллюсков, описанных для Арала второй половины 1970-х лет. В выборке можно найти немногочисленные отдельные экземпляры почти соответствующие по контуру створки раковины и апикальному углу описаниям эталонных форм синдосмии второй половины 1970-х лет. Остальные признаки в выборке довольно изменчивы. Особенно обращает на себя внимание изменчивость лигамента, сравнимая с изменчивостью лигамента Cerastoderma конца 1980-х – начала 1990-х годов при массовом выходе сердцевидок на поверхность грунта.
Итак, вселение синдосмии в залив Сары-Чаганак при неблагоприятном для азово-черноморских двустворок ионном составе воды повлекло за собой значительное повышение изменчивости, которое способствовало возникновению и дальнейшему отбору генотипов, жизнеспособных в аральской воде.
Одновременно с вселением S. segmentum началось разрушение экосистемы Аральского моря, вызванное как внешними (сокращение стока), так и внутренними (перестройка биотических отношений в результате акклиматизации гидробионтов) факторами. Расселение вида шло довольно быстрыми темпами (см. рис. 2.1), и, как бы, по свободному дну водоема. Во второй половине 1960-х годов зафиксирована самая низкая биомасса бентоса за весь период изучения бентоса Аральского моря (см. табл. 3.2). В 1966–1968 гг. залив Сары-Чаганак был абсолютно свободен от обитающих в грунте, как и синдосмия, моллюсков р. Hypanis и личинок хирономид; в 1968 г. опустошение прослеживалось по всему Малому и большей части Большого моря (Андреева, 1989). Таким образом, в конце 1960-х годов сложились исключительные условия для расселения синдосмии. Колоссальная плодовитость, наличие пелагической стадии развития, освобождающиеся лицензии, запасы органики [по мнению А.Ф. Карпевич (1975), захороненные в грунтах моря], способствовали быстрому расселению и наращиванию численности на вновь освоенных биотопах, а также сохранению в составе популяций всевозможных генотипов. При отсутствии конкуренции со стороны других видов по мере наращивания численности синдосмии происходило ужесточение внутривидовой конкуренции. Так, в 1972 г. при средней численности личинок двустворчатых моллюсков 8454 экз./м3 (Андреев, 1989) в среднем над 1 м2 дна в толще воды находилось 109 тыс. личинок. Даже, если очень грубо допустить, что численность личинок синдосмии составляла половину от общей численности двустворчатых моллюсков, то получаем колоссальное количество претендентов на обитание на 1 м2 грунта. Если учесть, что средняя численность синдосмии в эти же годы равнялась примерно 200–400 экз./м2, то право на дальнейшее существование имела примерно лишь одна личинка из 300, а с учетом продолжительности периода размножения и того, что пик размножения приходится на конец мая – начало июня, а также времени пребывания личинок в пелагиали – одна из 2000. Эти цифры еще более возрастают в мелководных хорошо прогреваемых районах моря, где в теплой воде процессы размножения и развития более ускорены. В последующем численность личинок над 1 м2 дна увеличивалась в связи с нарастанием численности взрослых, нерестящихся на дне моря особей (Андреев, Андреева, 1997а).
В условиях все возрастающей внутривидовой конкуренции, вероятно, и произошла специализация групп к определенному типу грунта, поскольку грунты Аральского моря на момент вселения S. segmentum были представлены широким для этого вида спектром – от тонкодисперсных жидких черных илов до твердых песчаных и песчано-ракушечных. Очевидно, что освоение всех типов грунтов для инфаунной S. segmentum при единой форме раковины было бы невозможно и вряд ли могло быть решено только за счет биотопической изменчивости. К середине 1970-х годов вычленились узкоспециализированные группы, относящиеся к жизненной форме обитателей тонкодисперсных илов (удлиненно-овальная форма), песчаных и песчано-ракушечных грунтов (треугольная форма), и менее специализированная овальная форма – обитатель более плотных илистых и песчано-илистых грунтов.
Итак, эволюция Syndosmya на первых этапах после вселения в Аральское море шла аналогично этому процессу среди моллюсков р. Hypanis. Потомки особей, выживших в аральской воде, после взрыва изменчивости, расселяясь по, практически, свободному от инфаунных видов зообентоса дну водоема через несколько поколений сформировали, отмечаемые с 1976 г. специализированные группы (формы), соответствующие жизненным формам моллюсков: обитателей песчаного и песчано-ракушечного грунта, илисто-песчаного и илисто-ракушечного грунта, а также илистого грунта. Раковины моллюсков, принадлежащих к этим группам (формам) по внешнему облику поразительно соответствуют раковинам видов Hypanis, обитавших на тех же типах грунтов (рис. 9.5). Даже величина апикального угла колеблется в близких пределах. Очевидно, приспособление к обитанию в грунте определенного механического состава требует соответствующей архитектоники раковины, что достаточно ярко наблюдается на аральских двустворках. Так, апикальный угол раковин моллюсков – обитателей песчаных грунтов Аральского моря был равен у Hypanis vitrea bergi — 115°, треугольной формы Syndosmya — 110–120°, в последние годы до 125°, C. isthmicum 1976 г. — 95–118°, Cerastoderma с песков в районе 11 станции 1994 г. — 107°. Интересно, что величина апикального угла для C. isthmicum из других водоемов колеблется в очень близких пределах: Каспийское море — 95–105°, Азовское — 100–110°, Черное – 103°. Обитавшие в Черном море Cerastoderma clodiense и Cerastoderma glaucum имели апикальный угол также близкий по величине к таковому обитателей песчаных грунтов Аральского моря — 120° и 110–120° соответственно.
<![if !vml]>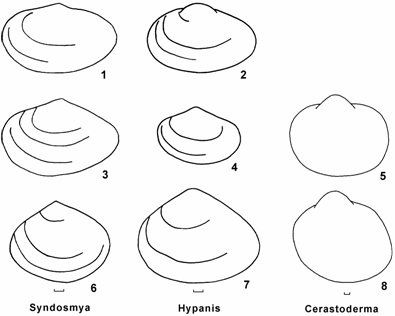 <![endif]>
<![endif]>
Рис. 9.5. Жизненные формы инфаунных двустворчатых моллюсков Аральского моря.
1, 2 – тонкодисперсных илистых грунтов; 3, 4, 5 – илистых и песчано-илистых грунтов; 6, 7, 8 – илисто-ракушечных и песчаных грунтов. Масштаб 1 мм.
Раковины аральских обитателей илистых и песчано-илистых грунтов отличались большим апикальным углом: Hypanis minima. minima — 135°, овальная форма Syndosmya — 130–135°, Cerastoderma с условно равноплечим контуром со станции 1 в 1976 г. — 130–135°.
У обитателей тонкодисперсных илистых грунтов H. sidorovi Star. и удлиненно-овальной формы Syndosmya апикальный угол составлял 140° и более.
Наличие четко выраженных морфологических форм, соответствующих определенным жизненным формам моллюсков, в течение почти двух десятков лет, их совместное нахождение в течение ряда лет на сером иле – грунте в той или иной степени приемлемом для жизнедеятельности любой из форм, а также наличие биотопической изменчивости внутри этих морфологических форм (изменение морфометрических индексов при обитании в разных районах моря), позволяет предположить наличие видообразовательного процесса среди синдосмия, акклиматизированной в Аральском море. В противном случае при наличии пелагической личинки, пребывающей в планктоне от одной недели до полутора месяцев (Гальперина, 1974), изменчивость инфаунной S. segmentum должна была бы быть представлена одним непрерывным рядом от треугольного контура раковины до удлиненно-овального, отражающим биотопическую изменчивость.
Исходя из видового описания (Скарлато, Старобогатов, 1972; Старобогатов, 1974) и анализа черноморский популяций S. segmentum (см. главу 7), в Аральское море, вероятнее всего, были вселены моллюски по внешнему облику близкие к треугольной форме Syndosmya из сборов 1977–1978 гг. Обилие площадей илистых грунтов и тонкодисперсных илов, свободных на период заселения от макрозообентоса, то есть наличие в экосистеме моря вакантных лицензий, способствовало отбору моллюсков с более длинной и менее выпуклой раковиной, завершившемуся созиданием еще двух форм Syndosmya. Эти формы по внешнему облику и, отчасти по строению замка, напоминали другие виды рода Syndosmya, обитающие на илах в Черном море. Иными словами, заполнение вакантных лицензий экосистемы Аральского моря вело к созданию форм – викариатов черноморским видам Syndosmya.
Итак, примерно до начала – первой половины 1970-х годов воды Аральского моря представляли собой зону смешения, занимаемую олигогалинными водными массами, заключенными между соленостями 3–5 –– 12–14 ‰. На окончание существования описываемой водной массы и пришлось расселение синдосмии и вычленение специализированных форм. Процесс вычленения специализированных форм занял незначительный временной отрезок, поскольку с самого момента вселения в среду специфического ионного состава вид был поставлен в очень жесткие условия выживания. Примерно в начале – середине 1970-х годов начался постепенный и неодновременный переход олигогалинных водных масс Аральского моря в мезогалинные при преодолении отдельными его районами зоны критической солености 12–14 ‰ (мезогалинного барьера).
На фоне этого постепенного процесса в поселениях синдосмии второй половины 1970-х годов при постоянстве внешнего облика раковины и лигамента, контура мантийной линии и изгиба замочной площадки наблюдались значительные вариации набора и формы зубов, контуров отпечатков замыкателей, скульптуры внутренней поверхности створки в примакушечной части раковины. Наиболее лабильны указанные признаки были у треугольной формы. Наименее изменчивой оказалась специализированная к обитанию на тонкодисперсных грунтах удлиненно-овальная форма. Причем, за весь период исследований у моллюсков этой формы не обнаружены утолщения на внутренней стороне створки в примакушечной части за счет разрастания кораллово-жемчужных образований.
Наличие у моллюсков треугольной формы более толстой раковины, сравнимой по толщине с раковинами одноразмерных Cerastoderma, упрочненной в примакушечной части за счет развития дополнительного ребра жесткости (гребень) и кораллово-жемчужных образований, обусловлено в 1970-е годы, вероятнее всего, избыточным содержанием кальция в водах Аральского моря по сравнению с материнским водоемом и механическим составом грунтов в местах обитания. Приуроченность треугольной формы к крупнозернистым оолитовым пескам (где эти признаки выражены ярче всего) и песчано-ракушечным грунтам, на которых почти не встречаются особи других форм и способствовала отбору моллюсков с наиболее толстыми и упрочненными раковинами. У овальной формы этого же периода времени на илисто-ракушечных грунтах также наблюдаются подобные, но менее ярко выраженные, преобразования раковины.
Итак, длительное, устойчивое существование разных типов грунтов ведет к сохранению в фауне Аральского моря вычленившихся форм синдосмии, из которых обычно совместно встречаются треугольная и овальная или овальная и удлиненно-овальная формы. Иногда возможны находки в одной дночерпательной пробе и всех трех форм вместе. А поскольку «сохранение различий в условиях симпатрии – это естественная проверка и наилучший критерий видового статуса рассматриваемых популяционных систем» (Грант, 1991, с. 208), то налицо событие видообразования среди синдосмия Аральского моря.
В последующем влияние критической и барьерной соленостей в условиях стабильного механического состава грунтов обуславливает повышенную изменчивость только признаков, не связанных с внешним обликом раковины: зубы, отпечатки мускулов-замыкателей, лигаменты. Причем изменчивость лигамента, конфигурации мантийной линии и других признаков выше у более специализированных треугольной и удлиненно-овальной форм.
Переход экосистемой моря через критическую и следующую барьерную солености отражается повышением изменчивости систематических признаков и увеличением количества уродливых форм. Примером могут служить сборы синдосмии из прибрежья острова Лазарева в июле 1978 г., Аральской бухты в мае 1980 г. Особенно показательно в этом отношении выборка из Аральской бухты в мае 1980 г., содержащая разные формы синдосмии. Развитие, оседание и рост моллюсков протекал летом 1979 г., и имеющиеся морфологические изменения отражают последствия воздействия критической солености. Причем воздействия критической солености на Syndosmya аналогичны воздействиям на Cerastoderma, собранных в августе 1979 г. в заливе Сары-Чаганак, ответвлением которого и является Аральская бухта. У тех и у других моллюсков наблюдается повышенная изменчивость морфологических признаков, выходящая за пределы видовой, а для Syndosmya, частично повторяющая спектр отклонений, имевших место в 1970 г., в первые годы расселения вида по Аральскому морю.
В 1980-е годы воды Аральского моря постепенно, по мере преодоления зоны критической солености, переходили в водные массы, заключенные между соленостями 12–14 ‰ и 24–28 ‰. В пределах этой водной массы по мере приближения к барьерной солености 24–28 ‰ наблюдается изменение характера грунтов по всей акватории Аральского моря. С одной стороны происходит уплотнение грунтов вследствие выпадения солей в осадок, и даже образование на дне сплошной корки соли, с другой стороны из-за обнажения прибрежных мелководий – резкое уменьшение песчаных грунтов. Катастрофическое изменение грунтов в результате выпадения солей в осадок при дальнейшем осолонении моря в конце 1980-х годов приводит к ухудшению условий обитания для удлиненно-овальной формы, численность которой резко снижается. В сборах 1990 г. эта форма еще единично прослеживается, в сборах 1993–1994 гг. в пробах из Малого моря ее нет (см. рис. 7.2). Сокращение площадей песчаных грунтов влечет за собой снижение численности треугольной формы. Изменение механического состава илистых грунтов в результате седиментации солей вызвало появление разнообразных контуров раковин у Syndosmya овальной формы, в частности, раковин с укороченным задним краем, несколько напоминающих раковины Syndosmya треугольной формы. В области влияния вод Сырдарьи, наоборот, происходит формирование более жидких грунтов, что вызывает отбор Syndosmya треугольной формы с некоторым удлинением заднего края раковины и увеличенным апикальным углом, приближающихся по внешнему облику к раковинам Syndosmya овальной формы.
Итак, исчезновение мягких грунтов в результате седиментации солей в конце 1980-х годов повлекло резкое снижение численности и биомассы удлиненно-овальной формы, вероятно вымершей в начале 1990-х годов, как и часть Cerastoderma с условно равноплечим контуром створок, обитавших в илистых грунтах. Сокращение площадей песчаных грунтов, также сопровождалось резким снижением численности и биомассы треугольной формы, а изменение характера илистых грунтов приводит к сближению очертаний створок треугольной и овальной форм Syndosmya.
Повторное прохождение экосистемы при распреснении Малого моря барьерной солености 24–28 ‰ обуславливает новые перестройки Syndosmya. Вновь, как и в первые годы после вселения наблюдается крайняя вариабельность мантийной линии, лигаментов и даже образование у части особей в выборках переднего лигамента. Причем большая изменчивость этих признаков характерна для моллюсков треугольной формы, практически лишившихся типичного биотопа.
Эволюционные изменения акклиматизированного в Аральском море двустворчатого моллюска синдосмия кратко можно представить следующим образом. Перемещение группы особей в водоем с водой, нарушающей ход эмбрионального развития, провоцирует взрыв мутагенеза. Наличие свободных лицензий вследствие вымирания части видов инфауны, высокая энергия размножения, пелагическая личиночная стадия, наличие резервов пищи способствуют сохранению и размножению всех жизнеспособных генотипов. По мере наращивания численности акклиматизантов в отсутствии межвидовой конкуренции (в этот период наблюдалось также резкое снижение запасов рыб-бентофагов вплоть до прекращения промысла) возрастает внутривидовая конкуренция, благодаря чему отбираются формы специализированные к обитанию на специфических биотопах. Не малую роль здесь, вероятно, играет и трофический фактор; вполне возможно, что для разных грунтов характерен свой специфический набор микроорганизмов, в том числе и диатомовых водорослей, входящих по сводке Е.А. Цихон-Луканиной (1987) в рацион синдосмии. К.А. Воскресенским (1973) была доказана избирательность питания сестонофагов, при этом указано, что получение нужной пищи нужного качества обеспечивают морфофункциональные адаптации к среде обитания.
Эволюция Syndosmya в Аральском море протекает в условиях постоянно изменяющегося гидролого-гидрохимического режима и биотического окружения. Небольшой период времени относительно стабильных условий обитания (1967–1979 гг.) после вселения Syndosmya segmentum в Аральское море способствовал отбору устойчивых форм, имеющих хиатус по ряду признаков. Преодоление экосистемой моря соленостных барьеров вновь вызывало повышенную изменчивость морфологических признаков, теперь уже внутри форм.
Несмотря на одновременное и аналогичное воздействие критической солености на синдосмию и церастодерму у синдосмии наблюдается менее разнообразный спектр изменчивости, потому что и в первые годы акклиматизации, и при смене биотического окружения после вымирания эпифаунистических видов эволюционные преобразования осуществлялись в пределах одной и той же адаптивной зоны: внутри грунта. После окончания действия критической, а в последующем и барьерной солености наблюдается стабилизация морфологических признаков в пределах нормы, соответствующей определенному типу грунта. Утрата определенного типа грунта ведет к снижению численности и даже вымиранию специализированных форм.
Дальнейшее усыхание Большого моря должно привести к сокращению ареала и снижению численности треугольной формы. Небольшое повышение уровня Малого моря за счет увеличения стока Сырдарьи после 1992 г. позволит сохранить имеющиеся небольшие по площади песчаные биотопы и, следовательно, треугольную форму синдосмии. Для овальной формы синдосмии указанные преобразования не будут иметь значения, поскольку в 1990-е годы илистые грунты преобладали по площади, а градиенты солености продолжают оставаться в пределах толерантного диапазона. Пересечение экосистемами Большого и Малого морей барьерных соленостей при продолжающемся осолонении Большого моря и распреснении Малого вновь вызовет повышенную изменчивость морфологических признаков, амплитуда которой будет затухать после прекращения возмущающего воздействия солености.
Дальнейшее существование синдосмии в Большом море будет определяться темпами осолонения. При достижении пороговой для этих двустворок солености следует ожидать их выпадения из фауны Большого моря.
Видообразование двустворчатых моллюсков в Аральском море шло как в пределах одной адаптивной зоны (Hipanis, Syndosmya и частью Cerastoderma), так и при переходе в другую адаптивную зону (Cerastoderma и Dreissena).
В пределах одной адаптивной зоны, но занимая различные по механическому составу грунты, возникли виды, относящиеся к различным жизненным формам. Это обитатели песчаных и песчано-ракушечных грунтов: Cerastoderma (C. isthmicum до второй половины 1970-х лет, Cerastoderma частью по 1994 г.), треугольная форма Syndosmya, H. v. bergi. Обитатели илисто-песчаных и илисто-ракушечных грунтов: C. r. rhomboides, овальная форма Syndosmya, H. m. minima. Обитатели илистых грунтов: C. isthmicum (частью: вторая половина 1970-х – конец 1980-х годов), удлиненно-овальная форма Syndosmya, H. sidorovi .
При переходе в другую адаптивную зону в ходе последующей адаптивной радиации формируется букет «видов», относящихся к эпифаунистической жизненной форме (Cerastoderma первой половины 1990-х годов, большей частью). Занимая аналогичные экологические ниши, различающиеся лишь градиентами солености, сформировались D. p. aralensis и D. obtusecarinata, а также Dr. c. pallasi – представители одной эпифаунистической жизненной формы.
Следует подробнее остановиться на скорости эволюционных преобразований двустворок Аральского моря. Хорошо известно, что изменение условий обитания вызывает значительное увеличение изменчивости популяции как в период эволюционных трансформаций ископаемых животных (Невесская, 1967; Невесская с соавт., 1987; Шмальгаузен, 1983; Красилов, 1987; Расницын, 1987; Williamson, 1981; и др.), так и при экспериментальных образованиях новых форм (Шапошников, 1961; Беляев, 1983; Шварц, 1980; Сапунов, 1983; и др ).
Общеизвестно, что эволюция определяется сменой условий существования как в пространстве, так и во времени. При этом максимальные темпы эволюции определяются оптимальным сочетанием целого ряда факторов, важнейшими из которых по И.И. Шмальгаузену (1983) являются достаточно устойчивая кормовая база, отсутствие острой межвидовой конкуренции, многообразие условий существования и изменения этих условий во времени, отсутствие истребляющих факторов большой силы. «Наличие таких сочетаний дает объяснение явлениям, которые на первый взгляд кажутся парадоксальными» (Шмальгаузен, 1983, с. 339). Как было показано выше, в условиях перестройки экосистемы Аральского моря в 1960-е годы обстоятельства сложились таким уникальнейшим образом, что все важнейшие факторы, способствующие максимальным темпам эволюции, действовали совместно и одновременно, направляя эволюционные преобразования и переселенного вида S. segmentum и самостоятельного вселенца из осолоненных районов Арала C. isthmicum на освоение всевозможных биотопов моря.
Закономерно возникает вопрос о скорости видообразования и темпах эволюции двустворок Аральского моря. Ответ на него может быть найден в работах палеонтологов последних лет (Жерихин, 1987, 1992; Красилов, 1986; Невесская с соавт., 1987, 1989; и др.) и у Н.В. Тимофеева-Ресовского с соавторами (1973, 1977): на темпы эволюции может влиять и образование большего или меньшего числа экологических ниш в пределах одной и той же адаптивной зоны. Виды у двуполых и перекрестно оплодотворяющихся форм «могут возникать постепенно и медленно, а иногда быстро и «внезапно» (Тимофеев-Ресовский с соавт., 1977, с. 212). Конкретный цифровой материал (например, экспансия C. isthmicum в открытое море началась в первой половине 1970-х годов), полученный при изучении двустворок Аральского моря ошеломляет. Однако следует принимать во внимание темпы эволюции самой экосистемы Аральского моря. Немногим более, чем за два десятка лет море из солоноватого водоема превратилось в водоем с высокой, постоянно возрастающей соленостью, с обедненной биотой (при отсутствии ряда типичных для других морей трофических группировок) и измененным типом и скоростью продуцирования первичного органического вещества. Изолированное положение Арала исключало возможности расширения биоразнообразия за счет миграции.
Ситуация с событиями видообразования среди аральских двустворок приобретает более реальные черты в свете появившейся в последнее время информация о скорости видообразования. На основании палеонтологических материалов было показано (Красилов, 1969, 1987), что возможны два типа эволюции живого на Земле. Когерентный тип (т.е. согласованный) – медленная, плавная эволюция происходит в условиях устойчивой структуры сообществ, в условиях острой конкуренции и некогерентный – быстрые, радикальные преобразования в условиях распадающейся экологической системы и ослабленной конкуренции. Причем, в устойчивом сообществе конкуренция – это основной стабилизирующий фактор, ослабление которого в период кризиса может привести к дестабилизации – резкому увеличению размаха изменчивости. «Ослабление конкуренции допускает эволюционное экспериментирование, возникновение макрополиморфизма как основы быстрых эволюционных преобразований. По мере стабилизации условий макрополиморфные популяции, занимающие ряд адаптивных зон, распадаются и дают начало различным линиям адаптивной радиации» (Красилов, 1986, с. 73).
Аналогичные результаты получены при исследовании фаун замыкающихся и полностью замкнутых полуморских и солоноватых кайнозойских бассейнов. На примере этих фаун можно видеть неоднократно повторяющийся процесс адаптивной радиации немногочисленных форм, переживших гидрологический кризис (Невесская с соавт., 1989). Причем, исследования амплитуды изменчивости ископаемых видов моллюсков одних и тех же родов в разных бассейнах показали, что наиболее изменчивы виды, которые дают начало новым видам (Невесская, 1967). Считается также возможным интенсивное симпатрическое видообразование для морских фаун, особенно среди тех групп, для которых характерны пелагические личиночные стадии, поскольку пространственной изоляции между популяциями возникнуть не может. Этот процесс шел за счет освоения свободных экологических ниш путем как постепенного, так и резкого изменения признаков (Невесская, 1967; Невесская, Попов, 1976; Невесская с соавт., 1987).
При исследовании морских и солоноватоводных кайнозойских моллюсков установлено, что скорость видообразования и появления новых надвидовых таксонов в основном зависела от стабильности бентосных сообществ. При нарушении стабильности изменялась и трофическая зональность за счет полного выпадения моллюсков-детритофагов. Возникновение же новых сообществ создавали условия для быстрой эволюции и возникновения новых эндемичных таксонов родового и даже семейственного ранга. В случае нарушения стабильности сообществ проявлялась потенциально возможная скорость эволюции моллюсков. Наблюдалась «взрывная» эволюция в основе которой лежала незначительная часть таксонов ранее существовавшей биоты (Невесская, 1980; Невесская с соавт., 1989). Также было показано (Жерихин, 1987, 1992), что скорость эволюции в подобных ситуациях (условиях) может быть исключительно высокой – видообразование в течение первых десятков поколений.
Г.Х. Шапошниковым (1961, 1965, 1966) экспериментально доказана возможность быстрых преобразований вида. В его опытах по переносу тлей на другой вид кормового растения через 10–15 поколений получена форма, морфологически отличная и репродуктивно изолированная от исходной. Причем, основные изменения произошли в течение первых 7–10 поколений.
Аральские двустворчатые моллюски Cerastoderma и Syndosmya также обнаруживают исключительно высокие темпы видообразования. Так, Cerastoderma вышли на поверхность грунта в течение 10–15 лет, что соответствует смене примерно такого же числа поколений. К сожалению, скорость образования Cerastoderma с условно равноплечей раковиной, обитавших в илистом грунте, установить в настоящее время невозможно из-за уничтожения коллекций стандартных рейсов АралКазНИИРХ за 1960–1970-е годы.
В отношение скорости преобразования Syndosmya следует заметить, что уже в контрольной выборке с илов 1970 г. через 7–9 (по данным разных авторов) поколений с момента интродукции вида единично присутствовали моллюски внешне соответствующие эталонным описаниям форм второй половины 1970-х лет. В 1976 г. все три формы были широко распространены в Аральском море. Следовательно, через 13–15 лет со времени вселения S. segmentum образовавшиеся формы полностью освоили дно Аральского моря, имея в последствии довольно устойчивые ареалы.
Благодаря быстрой эволюции в фауне Аральского моря сохранялись и видоизмененные предковые формы (треугольная форма Syndosmya и инфаунные Cerastoderma – обитатели песчаных грунтов) и формы-потомки (овальная и удлиненно-овальная формы Syndosmya, условно равноплечая форма Cerastoderma и букет эпифаунистических Cerastoderma). И только резкое изменение условий обитания ведет к вымиранию части форм потомков (удлиненно-овальная форма Syndosmya и условно равноплечая форма Cerastoderma), при сохранении части форм-потомков и форм-предков. И если треугольная форма Syndosmya несмотря на все преобразования экосистемы Аральского моря сохранила почти все типовые признаки , то Cerastoderma, обитающие в песке, соответствуют лишь по габитусу раковин C. isthmicum, в то время как окраска и число ребер, лигамент и замок не имеют ничего общего с типовыми описаниями.
Итак, в условиях экологического кризиса Cerastoderma бурно эволюционируют с преобразованием во времени и самого предкового вида при сохранении лишь внешнего облика жизненной формы – обитателя песчаных грунтов, отбором группы – обитателей илистых грунтов и формированием букета «видов» при освоении новой адаптивной зоны. Причудливым образом в пределах одной клады переплетается несколько процессов видообразования: анагенетический и аллотопный, а при вступлении эволюции экосистемы моря в диверсификационную стадию, вероятно, подключаются и арогенные преобразования. Исследования в этом направлении фауны крупных водоемов показали, что различные механизмы видообразования не исключают, а дополняют друг друга (Brooks, 1950; Кожов, 1962; Старобогатов, Ситникова, 1992; и др.), в этом плане эволюция двустворчатых моллюсков Арала не являются исключением.
В отношении Syndosmya имеется наглядный пример, в какой-то мере противоречащий кладистической концепции, по которой кладообразующий вид освобождает арену жизни своим потомкам. Специфика видообразовательного процесса в Аральском море заключается в заполнении вакантных лицензий экосистемы, при сохранении во времени лицензий, занимаемых видами-кладообразователями. В этих условиях (условиях сохранения всех лицензий) возможно одновременное и длительное, даже в геологических масштабах, сосуществование видов-предков и видов-потомков, как и в экосистемах некоторых великих озер, в частности, отмечаемое для Байкала Я.И. Старобогатовым и Т.Я. Ситниковой (1990).
Таким образом, результатом эволюции экосистемы Аральского моря в условиях современного экологического кризиса явилось выщепление форм двустворчатых моллюсков, явно имеющих статус не ниже видового, если судить по морфологическим признакам, которыми оперирует современная систематика двустворчатых моллюсков. Основным механизмом запуска видообразовательного процесса явилось воздействие резкого изменения ионного состава окружающей среды, например, при вселении синдосмии в Аральское море или при переходе его экосистемой критической и барьерных соленостей, проявляющееся в запредельной изменчивости морфологических признаков моллюсков. Формирование новых таксономических единиц происходило подхватыванием и сохранением признаков соответствующих вакантным лицензиям экосистемы. При отсутствии вакансий амплитуда изменчивости признаков по мере прекращения возмущающего действия барьерной солености постепенно затухала.
Олигогалинные водные массы, заключенные между соленостными барьерами 3–5 и 12–14 ‰, представляют собой специфическую арену жизни, в пределах которой в Аральском море сформировалась специфическая солоноватоводная фауна. Причем вся фауна двустворчатых моллюсков была представлена эндемичными формами видового или подвидового ранга. Проникновение в эту арену жизни ни со стороны пресноводной малакофауны, отграниченной олигогалинным барьером (3–5 ‰), ни со стороны морской эвригалинной фауны, отсекающейся, вероятно, изогалиной 12 ‰ было невозможно. Подтверждениями могут служить ареалы пресноводных моллюсков Аральского бассейна и распространение C. isthmicum в условиях квазистационарного режима и при повышении солености моря. Процветание специфической аральской фауны было возможно только в пределах данной арены жизни, повышение солености воды привело к ее вымиранию.
Итак, эволюция двустворчатых моллюсков Аральского моря предопределена эволюцией его экосистемы. Превышение летальных границ соленостью воды моря вело к вымиранию видов. Достижение критической и барьерных соленостей в процессе осолонения моря для эвригалинных морского происхождения видов сказывалось непредсказуемым размахом фенотипической изменчивости, на основе которой при дальнейшей трансформации экосистемы и наличии лицензий шло видообразование.